下列事实不能用勒夏特利原理来解释的是
| A.增大压强,有利于SO2和O2反应生成SO3 |
| B.热的纯碱溶液去油污能力较强 |
| C.加催化剂使N2和H2在一定条件下转化为NH3 |
| D.常温下pH=3的H2SO4溶液中水的电离程度小于pH=3的NH4Cl溶液中水的电离程度 |
现有常温下的四份溶液:①0.01mol•L﹣1 CH3COOH溶液;②0.01mol•L﹣1盐酸;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 |
| C.将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
| D.将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
下列有关电解质溶液的推理,其中不正确的是( )
| A.室温下,pH=4的CH3COOH溶液和pH=10的NaOH溶液等体积混合, 所得溶液pH<7 |
| B.用蒸馏水稀释0.1mol/L CH3COOH溶液至0.01mol/L,若稀释过程温度不变,则稀释过程中c(H+) / c(CH3COOH)呈增大的趋势 |
| C.将0.2mol/L的弱酸HX溶液与0.1mol/L的NaOH溶液等体积混合,充分反应后,溶液中存在:2c(OH-) +c(X-)=2c(H+) + c(HX) |
| D.用0.2mol/L的NaOH标准溶液滴定HCl与CH3COOH的混合溶液,当中和至中性时,溶液中存在:c(Na+)+c(CH3COOH) = c(Cl-) + c(CH3COO-) |
下列叙述正确的是
| A.100℃纯水在pH=6,所以水在100℃时呈酸性 |
| B.pH=3的盐酸溶液,稀释至10倍后pH>4 |
| C.0.2mol·L-1的醋酸与等体积水混合后pH=1 |
| D.pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=7 |
(1)将0.15 mol/L稀硫酸V1 mL与0.1 mol/L NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=____________.(溶液体积变化忽略不计)
(2)常温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合而得,则溶液的pH________7(>、≥ 、=、<)。
②若溶液pH>7,则c(Na+)________c(A-),理由是________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是______(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol/L |
| B.若V1=V2,反应后溶液pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,错误的是( )

某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,下表中判断合理的是 ( )
| 编号 |
HX |
YOH |
溶液的体积关系 |
| ① |
强酸 |
强碱 |
V(HX)=V(YOH) |
| ② |
强酸 |
强碱 |
V(HX)<V(YOH) |
| ③ |
强酸 |
弱碱 |
V(HX)=V(YOH) |
| ④ |
弱酸 |
强碱 |
V(HX)=V(YOH) |
A、①③ B、②③ C、①④ D、②④
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 |
| B.水的离了积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 |
| D.水的离子积变大、pH变小、呈中性 |
下列可用于测定溶液pH且精确度最高的是
| A.酸碱指示剂 | B.pH计 | C.精密pH试纸 | D.广泛pH试纸 |
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB- H++B2- ,则下列说法中一定正确的是
H++B2- ,则下列说法中一定正确的是
A、在Na2B溶液中一定有:c(OH )=c(H
)=c(H )+c(HB
)+c(HB )+2c(H2B)
)+2c(H2B)
B、NaHB溶液可能存在以下关系:c(Na )>c(HB
)>c(HB )>c(OH
)>c(OH )>c(H
)>c(H )
)
C、NaHB水溶液中一定有:c(Na )+c(H
)+c(H )=c(HB
)=c(HB )+c(OH
)+c(OH )+c(B
)+c(B )
)
D、NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
| A.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 |
| B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 |
| C.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 |
| D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )
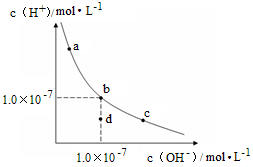
| A.升高温度,可能引起由c向b的变化 |
| B.该温度下,水的离子积常数为1.0×10-13 |
| C.该温度下,加入FeCl3可能引起由b向a的变化 |
| D.该温度下,稀释溶液可能引起由c向d的变化 |
右图是向100mL的盐酸中逐滴加入NaOH溶液时,混合溶液的pH变化图像,根据图像得出的结论正确的是
| A.原盐酸溶液的浓度为0.1mol/L |
| B.加入的NaOH溶液的浓度为0.1mol/L |
| C.至滴定终点用去NaOH为0.01mo1 |
| D.pH=12时,共加入NaOH溶液100mL |
用己知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确是
| A.滴定前,没有逐出滴定管下口的气泡 |
| B.用甲基橙作指示剂,指示剂刚变色,就停止滴定 |
| C.酸式滴定管用蒸馏水洗净后,直接加入己知浓度的盐酸 |
| D.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液 |
试题篮
()