常温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合。 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
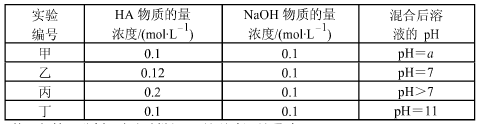
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?________________。
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系_____________。
A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是:___________
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=_______mol·L-1。
(5) 某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B===H++HB- HB- H++B2-
H++B2-
回答下列问题:
在 0.1 mol·L-1的 Na2B 溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
下表是不同温度下水的离子积的数据。试回答以下问题:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积 |
1×10-14 |
a |
1×10-12 |
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是 。
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
(3)在t2温度下测得某溶液pH=7,该溶液显__________(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合:
①若所得混合液为中性,则a∶b=____________;
②若所得混合液pH=2,则a∶b=____________。
常温下,用0.01mol·L-1NaOH溶液滴定20.00mL0.01mol·L-1CH3COOH溶液,所得滴定曲线如右图。下列说法正确的是
| A.a点对应溶液的pH=2 |
| B.b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) |
| C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应 |
| D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度 |
25℃下,0.1mol/L的Na2S溶液,下列叙述正确的是
| A.升高温度,溶液的pH降低 |
| B.加入NaOH固体,溶液中的c(Na+)、c(S2-﹣)均增大 |
| C.c(Na+)>c(OH﹣)>c(S2-﹣)>c(H+) |
| D.2c(Na+)=c(S2-﹣)+c(HS﹣)+c(H2S) |
现有体积相同、pH均为2的盐酸和醋酸,下列叙述错误的是
| A.盐酸溶液中的c(Cl-)与醋酸溶液中的c(CH3COO-)相等 |
| B.它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多 |
| C.分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-) |
| D.它们分别与足量CaCO3反应时,放出的CO2一样多 |
在25℃时将pH=11的NaOH 溶液与pH=3的CH3COOH溶液等体积混合后,下列关系式中正确的是
| A.c(Na+)=c(CH3COO﹣)+c(CH3COOH) |
| B.c(H+)=c(CH3COO﹣)+c(OH﹣) |
| C.c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+) |
| D.c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣) |
下列关于pH变化的判断正确的是
| A.温度升高,Na2CO3溶液pH减小 |
| B.氢氧化钠溶液久置于空气中,溶液pH变大 |
| C.新制氯水经光照一段时间后,溶液pH减小 |
| D.温度升高,纯水pH增大 |
下列关于25℃的NaHCO3溶液的相关事实,能够证明H2CO3为弱酸的是
| A.溶液中存在CO32- | B.溶液中c(H+)·c(OH-)=10-14 |
| C.与等物质的量的NaOH恰好中和 | D.溶液中c(Na+)>c(CO32-) |
燃烧含硫高的煤和石油是形成酸雨的重要原因,现取放置一段时间的雨水,经分析测得除H+外的各离子浓度为:c(NH4+)=2×10-5mol/L,c(Cl-)=6×10-5mol/L ,c(Na+)=1.9×10-5mol/L ,c(NO3-)=2.3×10-5mol/L, c(SO42-)=2.8×10-5mol/L,则此次酸雨的pH为
| A.3 | B.4 | C.5 | D.6 |
常温下,下列混合溶液的pH一定大于7的是
| A.0.01mol/L的盐酸和0.01mol/L的NaOH溶液等体积混合 |
| B.pH=3的盐酸和pH=11的氨水溶液等体积混合 |
| C.0.01mol/L的盐酸和0.01mol/L的氨水溶液等体积混合 |
| D.pH=3的醋酸和pH=11的NaOH溶液等体积混合 |
某学生的实验报告所列出的下列数据中合理的是
| A.用10mL量筒量取7.13mL稀盐酸 |
| B.用pH计测得某稀盐酸的pH为1.54 |
| C.广泛pH试纸润湿后,测得某溶液的pH为2.3 |
| D.用标准的盐酸滴定待测的NaOH溶液时,滴定完毕后,酸式滴定管中盐酸的读数为17.1mL |
现有常温下的四份溶液:①0.01mol•L﹣1 CH3COOH溶液;②0.01mol•L﹣1盐酸;③pH=12的氨水;④pH=12的NaOH溶液.下列说法正确的是
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 |
| C.将四份溶液稀释相同倍数后,溶液的pH:③>④,②>① |
| D.将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
下列叙述正确的是
| A.100℃纯水在pH=6,所以水在100℃时呈酸性 |
| B.pH=3的盐酸溶液,稀释至10倍后pH>4 |
| C.0.2mol·L-1的醋酸与等体积水混合后pH=1 |
| D.pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=7 |
将纯水加热至较高温度,下列叙述正确的是
| A.水的离子积变大、pH变小、呈酸性 |
| B.水的离了积不变、pH不变、呈中性 |
| C.水的离子积变小、pH变大、呈碱性 |
| D.水的离子积变大、pH变小、呈中性 |
试题篮
()