(12分)
(1)已知H2A在水中存在以下电离:H2A H++HA-,HA-
H++HA-,HA- H++A2-。回答问题:
H++A2-。回答问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性”或“无法确定”),
②某温度下,向0.1mol·L-1的NaHA溶液中滴入0.1mol·L-1KOH溶液至中性,此时溶液中以下关系一定正确的是 (填字母)。
A.c(H+)· c(OH-) =1×10-14
B.c(Na+)+c(K+)=2c(A2-)+c(HA-)
C.c(Na+)="0.05mol" ·L-1
D.c(Na+)= c(A2-)+c(HA-) +c(H2A)
(2)已知常温下:CaA(s) Ca2+(aq)+A2-(aq);△H>0,c(Ca2+)·c(A2—)为常数,记作:
Ca2+(aq)+A2-(aq);△H>0,c(Ca2+)·c(A2—)为常数,记作:
Ksp=c(Ca2+)·c(A2—)。试回答:
①温度升高时,Ksp (填“增大”、“减小”或“不变”,下同)
②滴加少量浓盐酸,c(Ca2+) ,原因是
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
下列叙述正确的是
| A.室温下pH=7的CH3COOH与CH3COONa的混合液中离子的浓度大小顺序为:c(Na+)> c(CHCOO-)> c(H+)= c(OH-) |
| B.0.1 mol/L KHS的溶液中,c(K+)= 2c(S2-)+ c(HS-)+ c(H2S) |
| C.25℃时,pH均为12的NaOH溶液和Na2CO3溶液中由水电离出的c(OH-),前者小于后者 |
| D.中和pH和体积相同的盐酸与醋酸溶液,消耗NaOH的物质的量相等 |
25℃时,浓度均为0.2 mol/L的NaHCO3溶液中,下列判断不正确的是 ( )
A.存在电离平衡HCO H++CO32— H++CO32— |
B.存在水解平衡HCO+H2O H2CO3+OH- H2CO3+OH- |
| C.将溶液加热蒸干、灼烧得Na2O2固体 |
| D.加入NaOH固体,恢复到原温度,c(OH-)、c(CO32—)均增大 |
下列表述或判断正确的是( )
| A.25℃时,pH=10的NaOH溶液与pH=10的氨水中:c(Na+)=c(NH4+) |
| B.相同条件下等物质的量浓度的①NaCl 溶液;②NaOH溶液;③HCl溶液中由水电离出的c(H+):③>①>② |
| C.在Na2CO3、NaHCO3两种溶液中,离子种类不相同 |
| D.25℃时,浓度为0.2 mol·L-1的Na2CO3溶液中只存在水解平衡,不存在电离平衡 |
下列说法正确的是( )
| A.0.lmol·L-l的醋酸加水稀释,c(H+)/c(OH-)减小 |
| B.体积相同、pH相同的醋酸和盐酸完全溶解等量的镁粉,后者用时少 |
| C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| D.VlLpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
在0.5mol/L的NaHSO3溶液中滴入石蕊,溶液变红。该溶液中HSO3-的电离程度______HSO3-的水解程度。
体积相同的NaCl、MgCl2、AlCl3溶液,完全沉淀其中的Cl-,需消耗等物质的量的AgNO3,则这三种溶液的物质的量浓度之比为( )
| A.3︰2︰1 | B.1︰2︰3 | C.6︰3︰2 | D.2︰3︰6 |
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
(1)向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是
(2)现将0.04mol·L-1HA溶液和0.02mol·L-1NaOH溶液等体积混合,得到缓冲溶液。①若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”),你得出该结论的依据是
②若HA为CH3COOH,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是
今有室温下四种溶液,有关叙述不正确的是( )
| |
① |
② |
③ |
④ |
| pH |
11 |
11 |
3 |
3 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合,若混合后溶液pH=4,则Va∶Vb=11∶9
下列说法正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如右表,下列叙述正确的是
| 酸 |
电离平衡常数 |
| 醋酸 |
K i=1.75×10-5 |
| 次氯酸 |
K i=2.98×10-8 |
| 碳酸 |
Ki1=4.30×10-7 Ki2=5.61×10-11 |
| 亚硫酸 |
Ki1=1.54×10-2 Ki2=1.02×10-7 |
A.将0.1mol/L的醋酸加水不断稀释,c(CH3COO—)始终减小
B少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO—==CO32—+2HClO
C.少量的反应的离子方程式为:SO2+H2O+Ca2++2ClO—==CaSO3↓+2HClO
D.25℃,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是Na2CO3
(9分) (1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度。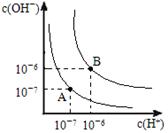
①100°C时1mol·L﹣1的NaOH溶液中,由水电离出的c(H+)= mol·L﹣1,KW(25°C)
KW(100°C)
(填“>”、“<”或“=”)。
②25°C时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是 (填“促进”“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 |
电离常数(25℃) |
| HCN |
K=4.9×l0-10 |
| CH3COOH |
K=1.8×l0-5 |
| H2CO3 |
K1=4.3×l0-7、K2=5.6×l0-11 |
③25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为 。
④25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,混合后所得溶液显碱性,则c(Na+) c(CH3COO-)(填“>”、“<”或“=”)。
⑤向NaCN溶液中通入少量CO2,所发生反应的化学方程式为
。
常温时,下列说法正确的是
| A.pH=5的NH4Cl溶液中,由水电离出的c(H+)为10-9 mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.在c(H+):c(OH-)=1:1012的溶液中,Na+、I-、NO3-、SO32-能大量共存 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
下列说法正确的是
| A.在纯水中加入醋酸会促进水的电离 |
| B.1 mL pH = 2的醋酸稀释至10 mL,pH=3 |
| C.常温下,0.1 mol·L –1氯化铵溶液加水稀释,溶液中所有离子浓度均减小 |
| D.加热Na2CO3溶液能提高其除油污的能力 |
(Ⅰ)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L在此温度下pH均为4的盐酸和(NH4)2SO4溶液中由水电离出的c(H+)之比为__________。
(Ⅱ)常温下,pH=10的强碱AOH和pH=4的酸HnB等体积混合后溶液显酸性,生成的盐化学式为___________。AOH与HnB完全中和所得溶液呈_________性,其原因用离子方程式表_______________________________________。
(Ⅲ)常温下将体积为v1、浓度为c1的一元酸HA与体积为v2、浓度为c2的一元碱BOH混合。
(1)若v1·c1=v2·c2,混合后的溶液pH>7,则一元弱酸的电离程度 (选填“>”、“<”或“=”)一元弱碱的电离程度;
(2)若v1=v2,一元弱碱的电离程度大于一元弱酸的电离程度,且混合后溶液pH<7,则c1 c2(选填“>”、“<”或“=”)。
(Ⅳ)常温下,0.1m01/L的下列溶液:
①HCl、②CH3COOH、③CH3COONa、④NaOH、⑤FeCl3、⑥NaCl。
(1)pH由小到大排列顺序为 (填序号);
(2)实验室配制⑤的溶液时常需加入少量盐酸,否则得到的是浑浊的溶液,产生浑浊的原因是(用离子方程式表示)
(Ⅴ)将硫酸铝溶液和碳酸氢钠溶液混合时,可看到的实验现象是 ,产生该现象的原因是 (用离子方程式解释原因)。
试题篮
()