在0.2mol/L的CH3COOH溶液中分别加入下列物质后,有关判断正确的是
| A.适当升高温度,CH3COOH的电离程度减小 |
| B.加少量NaOH固体,CH3COOH 的电离平衡向正方向移动 |
| C.加少量0.1mol/L的HCl溶液,溶液中c(H+)增大平衡向正方向移动 |
| D.加少量CH3COONa固体,CH3COOH 的电离平衡平衡向正方向移动 |
标准状况下,将V L A气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为( )
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
根据上述电离常数分析,下列表述不正确的是( )
A.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)=c(CN-),则a一定大于b
C.2 NaCN + H2O + CO2 =2 HCN + Na2CO 3
D.2CH3COOH + Na2CO3 → 2 CH3COONa + H2O + CO2 ↑
室温时,向稀醋酸中逐滴加入NaOH溶液,正确的是:
| A.向原醋酸中滴入NaOH溶液,可促进CH3COOH的电离,溶液的pH降低 |
| B.当滴入的NaOH与CH3COOH恰好反应时,所得溶液呈中性 |
C.当两者恰好完全反应时: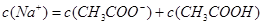 |
D.所得溶液中各离子浓度的关系为: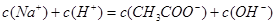 |
(12分)以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。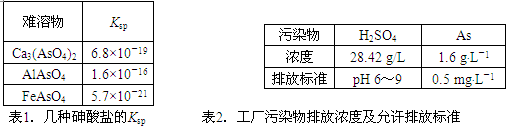
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= ________mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ________,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)的最大是 ___mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 __;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 _____。
下列有关溶液中粒子浓度的关系式中,正确的是
A.pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.下图中pH=7时: c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.下图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)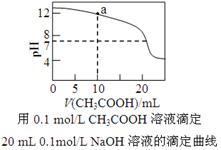
化合物A、B、C、D、E分别由H+、Na+、Al3+、Cu2+四种阳离子和CO32-、Br-、SiO32-、SO42-四种阴离子组成。已知①A、B、C三种溶液pH<7,D、E溶液pH>7②A、C的阴离子相同,D、E的阳离子相同 ③用石墨电极电解A的溶液,阳极有无色气体产生,阴极有红色物质生成 ④C溶液与D溶液反应能生成一种白色沉淀和一种气体,且此沉淀可溶于B的溶液,此气体通入E的溶液中可产生另一种白色沉淀。
请根据以上事实填空:
⑴写出B、C、E的化学式:B___________、C___________、E____________。
⑵D溶液的pH>7,原因是:(结合离子方程式说明)__________________________________。
⑶写出C溶液与D溶液发生反应的离子方程式:_______________________。
⑷若用石墨电极电解400mL 1.0 mo1·L—1 A的溶液,当阳极有2.24 L气体(标准状况)产生时,溶液的pH=_______________(设溶液的体积不变)。
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0–5 |
4.9×l0–10 |
K1=4.3×l0–7 K2=5.6×l0–11 |
则下列有关说法正确的是( )
A、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B、将a mol·L—1 HCN溶液与a mol·L—1 NaOH溶液等体积混合,混合液中:c(OH–)>c(H+),c(Na+)>c(CN–)
C、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D、NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +c(CO32–)
常温下下列关系的表述中,正确的是( )
| A.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1∶1 |
| B.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
| C.0.1 mol·L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D.浓度均为0.1 mol/L的三种溶液:①CH3COOH溶液;②NaOH溶液;③CH3COONa溶液,溶液的pH:②>③>① |
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看做是化学平衡的一种。请根据所学化学知识回答下列问题:
Ⅰ、已知0.01mol/L的NaHCO3溶液呈碱性。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
① ② ③ 。
(2)溶液中共有 种不同的粒子(指分子和离子)。
(3)该溶液中的离子浓度由大到小的顺序是: 。
(4)向该溶液中加入AlCl3溶液,有白色胶状沉淀生成,同时产生一种无色无味并能使澄清石灰水变浑浊的气体,写出该反应的离子方程式: 。
(10分)有A、B、C、D四种离子化合物,组成它们的离子分别为:
阳离子:Na+、Al3+、NH4+; 阴离子:OH-、NO3-、CO32-、HSO4-
为鉴别四种化合物,某学生分别取少量固体配成溶液,编号为A、B、C、D进行实验。实验过程和记录如下图所示(无关物质已略去)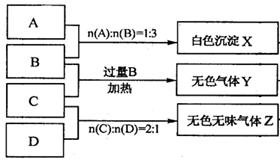
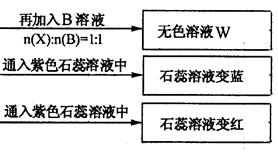
(1) Y、Z的化学式分别为:Y ;Z
(2)写出指定反应的离子方程式:
①加热条件下,C与过量B反应:
②D溶液显弱碱性的原因是(用离子方程式表示)
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是(用化学式表示)
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则溶液中离子浓度从大到小的顺序是:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题: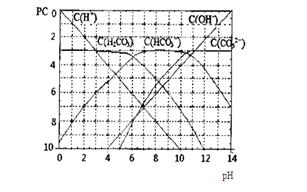
(1)在人体血液中,HCO3-能起到稳定人体PH的作用,请用电解质溶液中的平衡解释:
(用方程式表示)。
(2)H2CO3一级电离平衡常数的数值Ka1
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确 。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1。c(CO32-)=0.075 mol·L-1,若t1时刻在上述体系中加入100 mL0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
(5)请画出t1时刻后Li+和CO32-浓度随时间变化关系图(用虚线表示Li+ ,实线表示CO32-)。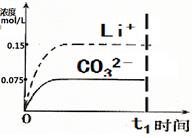
25°C时,几种弱酸溶液的PH如下表所示:
| 弱酸 |
CH3COOH |
H2SO3 |
HCN |
| 物质的量浓度mol/L |
0.01 |
0.01 |
0.01 |
| PH |
3.4 |
2.3 |
5.6 |
下列有关说法正确的是
A.相同PH的CH3COOH与HCN溶液中水电离的氢离子浓度CH3COOH溶液中的大
B.物质的量浓度相同的CH3COONa与NaCN溶液中,各离子浓度之和两者相等。
C.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在
如下关系:Ka ·K = Kw
D.0.01mol/L的Na2SO3溶液与0.01mol/L的CH3COONa溶液相比,一定是后者的碱性强
已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
| 溶质 |
NaHCO3 |
Na2CO3 |
NaCN |
| pH |
8.4 |
11.6 |
11.1 |
下列说法中正确的是
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度, 减小
减小
试题篮
()