下列变化规律不正确的是( )
| A.温度升高,水的电离平衡向右移动 |
| B.加水稀释时,醋酸钠的水解平衡向左移动 |
| C.增大压强,对醋酸的电离平衡影响不大 |
| D.向氯化铁溶液中加入氧化钠,水解平衡向右移动 |
25℃时,水中存在电离平衡:H2O  H++OH- ΔH>0。下列叙述正确的是
H++OH- ΔH>0。下列叙述正确的是
| A.将水加热,Kw增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
下列有关实验的叙述中,合理的是
①用pH试纸测得某新制氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,则测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需要的浓度
| A.②④⑥ | B.②③⑥ | C.①②④ | D.②③④⑤⑥ |
下列说法中,正确的是
| A.强电解质溶液一定比弱电解质溶液的导电性强 |
| B.强电解质的水溶液中不存在分子 |
| C.进行中和滴定时,锥形瓶不能用所盛溶液润洗 |
| D.不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
V mL Al2(SO4)3溶液中含Al3+a g,取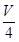 mL溶液稀释到4 V mL,则稀释后该溶液中SO42-的物质的量浓度是( )
mL溶液稀释到4 V mL,则稀释后该溶液中SO42-的物质的量浓度是( )
A. mol·L-1 mol·L-1 |
B.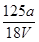 mol·L-1 mol·L-1 |
C.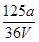 mol·L-1 mol·L-1 |
D.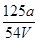 mol·L-1 mol·L-1 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是
| A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
| B.沉淀溶解后,将生成深蓝色的配合离子 2+ |
| C.向反应后的溶液中加入乙醇,溶液没有发生变化 |
| D.在2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH >a,则该电解质可能是
| A.NaOH | B.H2SO4 | C.AgNO3 | D.Na2SO4 |
下列说法正确的是
| A.在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 |
| B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-) ,且c(Mg2+)∙c(CO32-)=6.82×10-6 |
| C.对于反应2N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ∙mol-1,它只在高温下自发进行 |
| D.常温下,将0.2 mol∙L-1某一元碱(ROH)溶液和0.1 mol∙L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25℃) |
1.8×l0–5 |
4.9×l0–10 |
K1=4.3×l0–7 K2=5.6×l0–11 |
则下列有关说法正确的是( )
A、等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B、将a mol·L—1 HCN溶液与a mol·L—1 NaOH溶液等体积混合,混合液中:c(OH–)>c(H+),c(Na+)>c(CN–)
C、冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D、NaHCO3和Na2CO3混合液中,一定有c(Na+)+ c(H+)=c(OH–)+ c(HCO3–) +c(CO32–)
有一种非常活泼的碱金属的酸式盐AHB,它的水溶液呈弱碱性,现有下列说法,其中正确的是
A.该盐的电离方程式为:AHB A+ + HB- A+ + HB- |
| B.HB-的电离程度大于HB-的水解程度 |
| C.同浓度的AOH溶液和H2B溶液,电离程度:前者大于后者 |
| D.在溶液中离子浓度大小顺序为:c(A+)> c(OH-)>c(HB-) >c(H+)>c(B2-) |
室温下,已知一种c(H+)=1×10-3mol·L-1的酸和一种c(OH-)=1×10-3mol·L-1的碱溶液等体积混合后溶液呈酸性,其原因可能是:
| A.等浓度的强酸和弱碱溶液反应 | B.生成了一种强酸弱碱盐 |
| C.浓的强酸和稀的强碱溶液反应 | D.浓的弱酸和稀的强碱溶液反应 |
室温下,向pH=13的氢氧化钡溶液中加入等体积的下列溶液后,滴入石蕊试液,出现蓝色,该溶液可能是:
| A.0.05 mol·L-1的硫酸溶液 |
| B.0.1 mol·L-1的硫酸钠溶液 |
| C.pH=1的醋酸溶液 |
| D.pH=1的盐酸 |
0.1mol·L-1CH3COOH溶液中加水或加入少量CH3COONa晶体时,都会引起的变化的是:
| A.溶液的pH增大 | B.CH3COOH的电离程度变大 |
| C.溶液的导电能力减弱 | D.溶液中c(OH-)减小 |
下列说法正确的是( )
| A.将NaOH溶液和氨水溶液各稀释一倍,二者的OH-浓度均减小到原来的一半 |
| B.如果盐酸的浓度是醋酸浓度的两倍,则盐酸中的H+浓度是醋酸的两倍 |
| C.强电解质溶液的导电能力一定比弱电解质溶液强 |
| D.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需NaOH和醋酸所需NaOH相等 |
同体积同物质的量浓度的几种可溶性盐的溶液中,一定具有相同的( )
| A.溶质的物质的量 | B.溶质的质量 | C.溶质的摩尔质量 | D.离子总数 |
试题篮
()