在盛有1mL1mol·L-1AlCl3溶液的试管中加入2 mL10%的NH4F溶液,再加入1mL3mol·L-1氨水,没有生成白色沉淀,其原因是( )
| A.溶液的碱性不够强 | B.Al3+不与氨水反应 |
| C.生成的Al(OH)3溶解了 | D.Al3+几乎都与F-结合生成了新的物质 |
请回答下列问题:
(1)①现有0.1mol/L的纯碱溶液,若用pH试纸测定溶液的pH,其正确的操作是 。
②纯碱溶液呈碱性的原因是(用离子方程式表示) 。
(2)①已知4.4g丙烷完全燃烧生成二氧化碳气体和液态水,并放出222.0kJ的热量,请写出反应的热化学方程式: 。
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ/mol,实验测得甲烷与丙烷的混合气体1mol完全燃烧生成液态水和二氧化碳气体时,放热1776.7kJ,则混合气体中甲烷与丙烷的体积比为 。
pH=11的x、y两种碱溶液各5mL,分别稀释至500mL,其pH
与溶液体积(V)的关系如图所示,下列结论正确的是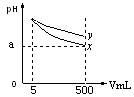
| A.相同温度下,x的的电离平衡常数小于y |
| B.若x、y是一元碱,等物质的量浓度的盐酸盐溶液,y的pH大 |
| C.若x、y都是弱碱,则a的值一定大于9 |
| D.完全中和x,y两溶液时,消耗同浓度稀硫酸的体积V(x)>V(y) |
下列说法错误的是
| A.将pH=4的醋酸稀释后,溶液中所有离子的浓度均减小 |
| B.pH=11的某溶液中,水的电离可能促进也可能是抑制 |
| C.改变条件使醋酸的电离平衡向右移动,醋酸的电离度可能增大也可能减小 |
| D.改变条件使醋酸钠溶液中的醋酸根离子浓度增大,溶液的pH可能减小也可能增大 |
常温常压下,将amolCO2气体通入1L1mol/L的NaOH溶液中,下列对所得溶液的描述不正确的是
| A.当1/2<a<1时,所得溶液中一定存在: c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.当a=1时,所得溶液中存在: c(OH-)+c(CO32-)=c(H+)+c(H2CO3) |
| C.当a=1/2时,所得溶液中存在: c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| D.当a=2时,随着CO2气体的通入,溶液中水电离出c(H+)有如上图变化关系 |
室温下,下列叙述正确的是(溶液体积变化忽略不计)
| |
① |
② |
③ |
④ |
||||
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
||||
| pH |
11 |
11 |
3 |
3
|
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
| A.2.0mol/L | B.1.5 mol/L | C.0.18 mol/L | D.0.24mol/L |
下列推断或表述正确的是 ( )
| A.澄清石灰水与足量小苏打溶液混合的离子方程式为:Ca2++OH-+HCO3- |
| B.向2.0mL浓度均为0.1 mol·L-1的KCl、KI混合液滴加1~2滴0.01 mol·L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
| C.将体积相同pH均为1的盐酸和醋酸加水稀释至pH为3,盐酸的体积变化大,证明醋酸是弱酸 |
| D.25℃时,pH=4.7,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中。(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
某ⅠA族金属的酸式盐AHB溶液,在室温下呈弱碱性。下列说法正确的是
A.该盐的电离方程式为:AHB A++H++B2- A++H++B2- |
| B.AHB溶液中加入少量的AOH,HB-的电离度增大,c(H+)增大 |
| C.AHB 溶液各离子的物质的量浓度大小顺序为:c(A+)>c(HB-)>c(OH-)>c(H+) |
| D.中和等物质的量的H2B和H2SO4所需NaOH的量前者大于后者 |
下列图像表达正确的是( )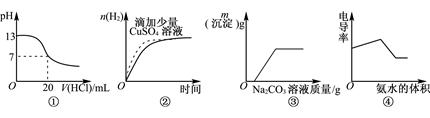
| A.图①表示25℃时,和0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 |
| B.图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应 |
| C.图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 |
| D.图④表示向盐酸和醋酸混合溶液中滴入氨水 |
某固态混合物中含有mgKNO3和若干不溶于水的杂质,将此混合物加入ng水中,在10℃、40℃、75℃时观察,充分溶解后的结果如下(溶解度曲线如图所示):
| 温度 |
10℃ |
40℃ |
75℃ |
| 未溶固体 |
261 g |
175 g |
82 g |
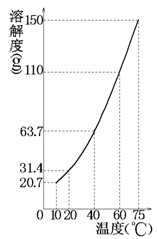
通过计算回答:
(1)m、n的值各为多少?
(2)75℃时所得溶液是否饱和?
(3)在什么温度将mg硝酸钾溶于ng水中恰好达到饱和状态?
工业常利用CO来制氢气。已知在25℃时:
C(s,石墨) + 1/2 O2(g) =" CO(g) " △H1= -111kJ/mol
H2(g) + 1/2 O2(g) = H2O(g) △H2= -242kJ/mol
C(s,石墨) + O2(g) = CO2(g) △H3= -394kJ/mol
(1)在25℃时,CO(g) + H2O(g)  CO2(g) + H2(g) △H=_____________。
CO2(g) + H2(g) △H=_____________。
(2)在2L密闭容器中,将2 mol CO与3 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
(3)将(2)中的平衡后的混合气体通入300mL 6mol/L NaOH溶液中,充分吸收,所得溶液中离子浓度由大到小的顺序为____________________________________ _____________。
_____________。
(4)将(3)中剩余的气体通过足量浓硫酸后,再与足量氧气用电火花引燃后通入足量的过氧化钠中,过氧化钠的质量增重______g。
(5)工业上也可以用CO和H2生产甲醇:CO(g) + 2H2 (g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变,
(g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变, 增大容器的体积,则平衡_________(填字母)
增大容器的体积,则平衡_________(填字母)
| A.不移动 | B.向正反应方向移动 |
| C.向逆反应方向移动 | D.无法判断移动的方向 |
等体积,浓度均为0.1mol/L的三种溶液:
①CH3COOH溶液、②HSCN溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积[(v)随时间(t)变化的示意图所示,
下列说法正确的是
| A.物质酸性的比较:CH3COOH>HSCN>H2CO3 |
| B.反应结束后所得两溶液中,c(CH3COO—)>c(SCN—) |
| C.上述三种溶液中由水电离的c(OH—)大小:NaHCO3>CH3COOH>HSCN |
| D.CH3COOH溶液和NaHCO3溶液反应所得溶液中: |
c(CH3COO—)+c(CH3COOH)=0.10mol·L-1
下列说法正确的是
| A.物质的量浓度均为0.1mol·L-1的(NH4)2SO4、(NH4)2Fe(SO4)2两种溶液中,c(NH4+)相同 |
| B.25℃时,在0.1mol·L-1的CH3COOH溶液中加入CH3COONa固体,溶液的pH一定小与7 |
| C.25℃时,将0.1mol·L-1的NaOH溶液与pH=1的稀硫酸等体积混合,混合后的溶液pH=7 |
| D.将同浓度的NaAlO2溶液与Na2CO3溶液混合后,可以生成白色沉淀,并产生气泡 |
试题篮
()