(9分) 已知有关物质的氧化性强弱顺序为:浓硫酸>Fe3+>H+>Fe2+。称得 60 g 铁粉与100 mL 浓硫酸在加热的条件下反应,反应最终有固体剩余,共收集到标准状况下气体22.4 L,气体的质量为39.2 g。试回答以下问题:(又知:2Fe 3++ Fe = 3Fe2+)
(1)在加热的条件下开始反应到最终有固体剩余,还涉及到的化学方程式有:
_______________________________________________________________________;
(2)求浓硫酸的物质的量浓度;
(3)反应最终剩余固体的质量。(写出简单的计算过程)
(7分) 由Cl-、Br-、CO32-、SO32-、SO42-、Na+、Fe3+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加足量新制饱和的氯水,溶液变黄,无气体产生,再加入汽油振荡,静置,汽油层呈橙红色,用分液漏斗分离。
②向分液后所得的水溶液中加入BaCl2和盐酸的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生。
请认真分析后回答下列问题:
(1)原溶液中是否含有Na+ (填“是”“否”或“无法确定”,下同。),原溶液中是否含有Cl- 。
(2)步骤①中溶液变黄的原因是(用离子方程式表示):
______________________________________________________________________。
(3)原溶液中是否含有SO32-、SO42-: (填“都有”、“都没有”、“仅有一种”或“至少有一种”)。理由是_____________________________________________________。
下列关于电解质溶液中离子关系说法中错误的是( )
| A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液: c(NaOH) < c(Na2CO3) < c(CH3COONa) |
| B.pH = 2的HA溶液与pH = 12的MOH溶液任意比混合: c(H+) + c(M+) = c(OH-) + c(A-) |
| C.在pH=13的Na2S溶液中,Al3+、Cl-、CH3COO-不能大量共存 |
| D.由水电离出的氢离子浓度为10-1mol/L的溶液中,SO32-、NO3-、Cl-、Na+可能大量共存 |
向体积为Va的0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系正确的是
| A.Va<Vb时:c (CH3COOH) +c (CH3COO-)>c (K+) | |
B.Va=Vb时:c (CH3COOH) +c (H+)>c (OH-) |
C.Va>Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+) |
| D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-) |
下列有关二元弱酸H2A的盐溶液的说法中,正确的是
A.在NaHA溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+)
B.在NaHA溶液中一定有:c(Na+)>c(HA-)>c(H+)>c(OH-)
C.在Na2A溶液中:c(Na+)=c(HA-)+c(OH-)+2c(A2-)
D.在Na2A溶液中:c(OH-)=c(H+)+c(HA-)+2 c(H2A)
下列叙述正确的是
A.pH均为11的NaOH和 溶液中,由水电离产生的 溶液中,由水电离产生的 相同 相同 |
| B.pH均为11、等体积的NaOH溶液和氨水,加入等体积的水后,前者的pH大于后者 |
C.0.1  溶液中: 溶液中:   |
| D.等体积、等物质的量浓度的乙酸和乙酸钠溶液混合后呈酸性,则 |
 >
> >
> >
> >
>
已知0.1mol/L的二元酸H2A溶液的pH=4,则下列说法中不正确的是 ( )
A.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-)
B.在Na2A溶液中一定有:c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.在Na2A和NaHA的两种溶液中离子种类相同
D.在溶质物质的量浓度相等的Na2A和NaHA溶液中,阴离子总数相等
下列各溶液中,有关成分的物质的量浓度关系正确的是 ( )
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
D.pH相等的(NH4)2SO4溶液,(NH4)2Fe (SO4)2溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2Fe (SO4)2]<c(NH4Cl)
已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol/L的NaHSO3和NaHCO3两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是( )
A、c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B、c(Na+)+c(H+)=c(HRO3-)+ c(RO32-)+c(OH-)
C、c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D、c(Na+)=c(HRO3-)+(H2RO3)+2c(RO32-)
关于下列各比较对象,前者一定大于后者的是
A.将pH均为11的NaOH溶液和氨水溶液分别稀释成pH=10的溶液,所加水的量
B.物质的量浓度相等的Na2CO3溶液与(NH4)2CO3溶液中CO3 的物质的量浓度
的物质的量浓度
C. 常温下pH=5的NaHA溶液中c(H2A)与c(A )
)
D. 等浓度的氯化钠和苯酚钠溶液中水的电离程度
下列说法中不正确的是 ( )
| A.将纯水加热至较高温度,水的离子积变大,pH变小,呈中性 |
| B.氨水和盐酸混合后溶液呈酸性,溶液中离子浓度大小关系一定存在:c(NH4+)>c(H+) |
| C.相同温度下,pH=2的醋酸溶液与pH=2的盐酸中c(H+)之比为1:l |
| D.向盛有少量Mg(OH)2沉淀的试管中加入NH4Cl浓溶液,振荡,沉淀会逐渐溶解 |
在25℃时,将pH=12的NaOH溶液与pH=2的CH3COOH溶液等体积混合,下列有关所得溶液的说法中错误的是
| A.溶液一定呈酸性 |
| B.向反应后的溶液中加入几滴稀盐酸,溶液的pH变化不大 |
| C.溶液中可能存在:c (H+) = c (CH3COO-)+c (OH-) |
| D.设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:Ka·Kh=Kw |
下列溶液中微粒的物质的量浓度关系正确的是
| A.pH相等的①NH4Cl、②(NH4)2SO4、③NH4HSO4的溶液中,c(NH4+)大小:①=②>③ |
| B.将物质的量相等的KHC2O4和H2C2O4溶于水配成溶液:2c(K+)=c(HC2O4-)+ c(H2C2O4) |
| C.0.1mol·L-1 K2HPO4和0.2mol/L KH2PO4的混合溶液:c(K+)+c(H+)=c(H2PO4-)+2c(HPO42-)+3c(PO43-)+c(OH-) |
| D.0.1mol·L-1 CH3COONa与0.15mol·L-1 HCl等体积混合:c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-) |
下列溶液中微粒的物质的量浓度关系正确的是
A.向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中: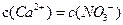 |
| B.将0.2 mol·L-1NaA溶液和0.1 mol·L-1盐酸等体积混合所得的碱性溶液中(A- 为酸根离子):c(Na+)>c(AlO2-)>c(C1-)>c(0H-) |
| C.0.1 mol/L-1NaAl02溶液中:c(Na+)>c(AlO2-)>c(OH-)>c(H+) |
| D.浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合溶液中: |
2c(OH-)=2c(H+)+c(CH3COOH)
试题篮
()