某学习小组依据反应:SO2(g)+ Cl2(g)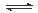 SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
SO2Cl2(g) △H<0,设计制备磺酰氯(SO2Cl2)的装置如图甲,有关信息如表所示。
| |
SO2Cl2 |
Cl2 |
SO2 |
| 熔点/℃ |
–54.1 |
–101 |
–72.4 |
| 沸点/℃ |
69.1 |
–34.6 |
–10 |
| 性质 |
遇水发生剧烈水解 |
|
|
(1)若用浓盐酸与高锰酸钾为原料制取Cl2,反应的离子方程式为______________;
(2)B仪器的作用是________________;
(3)为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择_____。
A.冰水浴 B.常温 C.加热至69.1℃ D.沸水浴
(4)如果通入的Cl2或SO2含有水蒸气,氯气和二氧化硫可能发生反应的化学方程式为____。
(5)实验时先通入干燥的Cl2将A装置中的空气赶走,再缓慢通入干燥的SO2,即发生反应。充分反应后,继续通入Cl2使装置中的SO2进入烧杯中被吸收。分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液W。经分析SO2Cl2与H2O反应属于非氧化还原反应,写出该反应的化学方程式___________________。
(6)GET公司开发的Li-SO2Cl2军用电池,其示意图如图乙所示,已知电池反应为:2Li+SO2Cl2 = 2LiCl+SO2,则电池工作时,正极的电极反应式为__________________。
据报道,苹果公司开发了一种以液态甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是电化学过程的示意图。

已知甲池的总反应式为:2CH3OH+3O2+4KOH K2CO3+6H2O,请填空:
K2CO3+6H2O,请填空:
(1)充电时:①原电池的负极与电源______极相连,②阳极的电极反应为________。
(2)在此过程中若完全反应,乙池中B极的质量增加648g,则甲池中理论上消耗O2_______L(标准状况下)。
(3)电解制备Al(OH)3时,电极分别为Al片和石墨,电解总反应方程式为 。
市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下: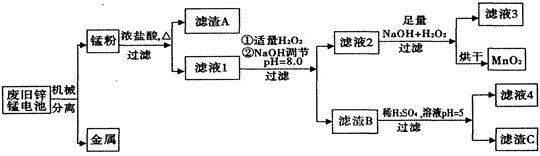
已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 / Mn(OH)3 |
| 开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
| 完全沉淀pH(c≤1.0×10-5mol/L) |
3.7 |
9.6 |
8.0 |
8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是____________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)写出滤液2中的Mn2+变成MnO2的离子方程式_________________________。
(3)写出滤渣B与稀硫酸在pH=5时反应的化学方程式______________________。
(4)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(5)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液的总反应方程式为______________________。
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是Ni(OH)2 + M =" NiOOH" + MH
已知:6NiOOH + NH3 + H2O + OH-="6" Ni(OH)2 + NO2- 下列说法正确的是
| A.电池放电过程中,正极电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH- |
| B.充电过程中阴极的电极反应式:H2O + M + e-="MH" + OH-,H2O中的H被M还原 |
| C.充电过程中OH-离子从阳极向阴极迁移 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
氰(CN)2的化学性质与卤素很相似(X2),称为拟卤素,氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱、比碘强。
(1)HCN分子中含有4个共价键,写出HCN的结构式:____________。
(2)KCN溶液显碱性,原因是____________(用离子方程式表示)。
(3)下列有关方程式不正确的是____________。
| A.(CN)2+2NaOH===NaCN+NaCNO+H2O |
| B.MnO2+4HCN===Mn(CN)2+(CN)2+2H2O |
| C.I2+2KCN===2KI+(CN)2 |
| D.向NaBr(aq)和KCN(aq)中加入少量Cl2:Cl2+2NaBr===2NaCl+Br2 |
(4)25℃,0.1mol/LKOH溶液和0.2mol/LHCN溶液等体积混合,若溶液最终PH=8,则c(CN-) c(HCN),原因是 。此溶液中c(CN-)与c(HCN)差值的数值为:
(5)已知HCN可以在氧气中燃烧成CO2、H2O和N2,由此原理可以设计酸性条件下原电池,书写其负极反应式: 。
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是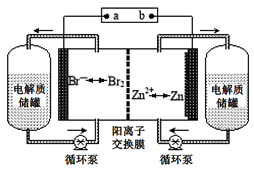
| A.阳离子交换膜可阻止Br2与Zn直接发生反应 |
| B.放电时正极的电极反应式为Br2+2e-=2Br- |
| C.充电时电极b连接电源的正极 |
| D.放电时左侧电解质储罐中的离子总浓度增大 |
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
A.Ag与空气中的氧气反应生成氧化银
B.Ag与空气中的含硫化合物反应生成硫化银
C.Ag与空气中氧及含硫化合物反应生成硫化银
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL 0.018mol·L-1的AgNO3溶液中加入50mL 0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)如图下所示原电池正极的反应式为 。

下列说法中正确的是
| A.原电池是把电能转变为化学能的装置 |
| B.原电池中电子流出的一极是负极,发生氧化反应 |
| C.原电池的两极发生的反应均为氧化还原反应 |
| D.形成原电池后,原电池中的阳离子向负极方向移动 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g |
运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2═2N2+6H2O。电解质为KOH溶液,则负极反应式为______________________________。
(2)向BaCl2溶液中通CO2不会出现沉淀,因此某同学根据相同的理由认为向BaCl2溶液中通入SO2也不会出现沉淀,但在实验验证中发现了异常情况,将SO2通入BaCl2溶液中开始并无沉淀,放置一段时间出现了白色沉淀,则产生该沉淀的离子反应方程式为_ 。
(3)有人认为Mg、Si的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写):___________________。
下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是
| A.电流由O2所在的铂电极流出 |
| B.该电池的负极反应式为:CH3CH2OH+3H2O -12e-=2CO2↑+12H+ |
| C.O2所在的铂电极处发生还原反应 |
| D.微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
化学反应原理是中学化学学习的重要内容。请回答下列问题:
(1)下列判断正确的是______________。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH2
则ΔH1﹤ΔH2
②H2(g)+ O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
则ΔH1﹤ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1﹤Q2
④CaCO3(s)===CaO(s)+CO2(g)ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s)ΔH2
则ΔH1﹤ΔH2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)
设计的原电池如图所示。

请回答下列问题:
①铜电极发生的电极反应为_____________________。
②溶液中Cu2+向________极移动。
(3)在一恒温、恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。

回答下列问题:
①Y的化学式是 。
②反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率,v(H2)= mol·L-1·min-1。
③能证明该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积分数保持不变 |
| B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) |
| D.混合气体的平均相对分子质量不变 |
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(4)室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如下图所示。下列有关溶液中离子、分子浓度大小关系的描述中正确的是____________。
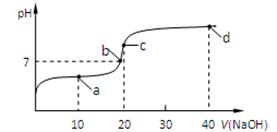
①.a点时:c(CH3COOH) >c(CH3COO-) > c(Na+) > c(H+) >c(OH-)
②.b点时:c(Na+)=c(CH3COO-) >c(H+) =c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)> c(CH3COO-) > c(OH-) >c(H+)
右图为某种乙醇燃料电池示意图,工作时电子流方向如图所示,下列判断正确的是
| A.X为氧气 |
| B.电极A反应式:CH3CH2OH-12e-+3H2O=2CO2+12H+ |
| C.电极材料活泼性:A>B |
| D.B电极附近溶液pH增大 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。RFC工作原理如图所示,下列有关说法正确的是
A.当有0.1mol电子转移时,a电极产生2.24LH2
B.b极上发生的电极反应是:4H2O+4e- =2H2↑+4OH-
C.c极上进行还原反应,B池中的H+可以通过隔膜进入A 池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
试题篮
()