已知A、B、C、D和E都是元素周期表中前36号元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的价电子数为2,D跟B可形成离子化合物,其晶胞结构如图。请回答:
(1)A的元素符号是_____
(2)B与A形成的化合物比C 与A形成的化合物沸点高,其原因是_____
(3)E元素名称是 ;它的+2价离子的电子排布式为_____
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;在晶体中与D距离最近且相等的B有 个, D跟B形成的离子化合物的熔点 D跟C形成的离子化合物的熔点(填“>”或“<”)。
(7分)
(1)NF3分子中N原子的杂化轨道类型为__________,该分子的空间构型为________
(2)[Cu(NH3)4]SO4属于配合物,其中 原子提供孤对电子。配合物 Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,Fe(CO)5晶体属于 (填晶体类型)。
(3)金属铜晶体的晶胞结构如图所示(面心立方晶胞):若该晶胞边长为dnm,铜的相对原子质量为64,阿伏加德罗常数为NA,则该晶体的密度为 g/cm3(列表达式)
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛。
(1)Li-SOCl2电池总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2,该反应的反应物和生成物中不存在的相互作用是 (填序号)。
a.离子键
b.共价键
c.氢键
d.范德华力
e.金属键
(2)亚硫酰氯(SOCl2)中硫的化合价为 ,1molSOCl2中的σ键数目是 。S、O、Cl三种元素电负性从大到小的顺序是 。
(3)在Li-SOCl2电池的碳正极中加入金属酞菁配合物可提高电池的容量和寿命。右图为一种铁酞菁配合物的结构,其中M为Fe2+,写出Fe2+的价电子排布式 。请在图中用箭头表示出配位键。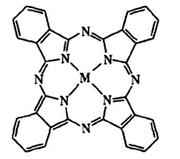
(4)人们发现Li+溶剂化倾向和形成共价键倾向很强,提出类似氢键的锂键。如LiF·HF中就存在锂键,下列LiF·HF的结构式正确的是(其中锂键用…表示) 。(填序号)
a. F—H…Li—F b.H—F…Li—F
【化学——选修《物质结构与性质》】
I.信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):
(1)s轨道与s轨道重叠形成的共价键可用符号表示为δs-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为δp-p,则H2O分子中含有的共价键用符号表示为________.
(2)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是________.
A.金刚石 B.干冰 C.食盐 D.固态氨
(3)已知:2H2O H3O++OH-,H3O+的立体构型是______,含1molH2O的冰中最多可形成“氢键”___mol.
H3O++OH-,H3O+的立体构型是______,含1molH2O的冰中最多可形成“氢键”___mol.
(4)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________.
II.A、B、C、D分别代表四种不同的短周期元素.A、B元素原子的价电子排布分别为ns1、ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有1个电子.
(1)A、C形成的化合物________(填序号).
①一定属于离子化合物
②一定属于共价化合物
③可能属于离子化合物,也可能属于共价化合物
(2)C原子的电子排布式为________.
(3)若A元素的原子最外层电子排布为1s1,写出A、C形成的含有配位键的一种微粒符号________.
(4)当n=2时,每个BC2中含有________个σ键,________个π键.当n=3时,B与C形成的晶体类型为________.
(5)若D元素与Fe形成某种晶体,该晶体的晶胞如图所示.则该晶体的化学式是________(用元素符号表示);若晶胞的边长为a nm,则合金的密度为________g/cm3.
选做[化学——选修3:物质结构与性质]已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大。A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素。
(1)E的基态原子电子排布式为 ,比较F和 E的各级电离能后发现,气态E2+再失去一个电子比气态F2+再失去一个电子难,其原因是 。
(2)写出 DA2的电子式 。
(3)DC2的一个晶胞如图所示,则图中实心球表示D还是C?
答: (填元素名称)。该晶体的密度为a g/cm3,则晶胞的体积是 (只要求列出算式)。
(4)AB32- 离子的空间立体构型为 ,AB气体在配合物中常作为配体,如近年来开始使用的一种新型汽油防震剂F(AB)5,该化合物中F元素的化合价为 。
[化学——选修3:物质结构与性质](15分)As、N、O等非金属元素的化合物在工业生产中有重要的应用。
(1)核电荷数比As小4的元素基态原子的电子排布式为 。
(2)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(3)已知氮的最高价氧化物为无色晶体.它由两种离子构成,其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化方式为 。
(4)磷化硼有多种晶型,下图示意的是磷化硼分子的分子结构图,其分子式为 。
(5)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如下图所示。由此判断该钙的氧化物的化学式为 。已知该氧化物的密度是ρg·cm -3.则晶胞离得最近的两个钙离子间的距离为 cm(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
选做[化学—物质结构与性质]氨是重要的化工原料,用途很广。
(1)合成氨工厂常用醋酸二氨合铜(由[Cu(NH3)2]+ 和CH3COO-构成)溶液吸收对氨合成催化剂有毒害的CO气体。
①醋酸二氨合铜所含的元素中,第一电离能最大的是 (填元素名称)。
②醋酸二氨合铜所含元素组成的单质,所属的晶体类型有 (填标号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
③第4周期元素中,基态原子与基态Cu原子具有相同未成对电子数的有 种(不含Cu)。
(2)BF3气体与NH3相遇立即生成一种白色晶体:BF3 + NH3= F3B—NH3。
①BF3和NH3分子的空间构型分别为 、 。
②晶体F3B—NH3中,B原子的杂化轨道类型为 。
(3)NH3可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。该物质易溶于水,在水溶液中以SO42-和N4H44+两种正四面体构型的离子存在。N4H44+遇碱生成一种形似白磷的N4分子。
①下列相关说法中,正确的是 (填序号)。
a.N4是N2的同分异构体
b.1mol N4分解生成N2,形成了4mol π键
c.白磷的沸点比N4高,原因是P—P键键能比N—N键大
d.白磷的化学性质比N2活泼,说明P的非金属性比N强
②画出N4H44+的结构(标明其中的配位键): 。
[化学—物质结构与性质]选做人类生活和工业生产都离不开金属。请根据相关信息回答:
(1)235U可用于核能发电。科学家们采用“气体扩散法”从UF6 获得高浓度的235U。已知UF6在常温常压下是固体,在56.4℃升华成气体,说明UF6属于 晶体。
(2)某丁香酸金属铜配合物的结构简式如下图所示,请回答。
该化合物中碳原子的杂化方式有 ,Cu原子的外围电子排布式 。
(3)某铜的配合物在煤的液化中起催化作用,其阳离子结构如下图。
①在该离子内部含有的化学键类型有 (填字母)。
a.离子键
b.极性键
c.非极性键
d.配位键
e.范德华力
f.氢键
②煤液化获得的甲醇经催化氧化可得到重要工业原料甲醛(HCHO)。甲醇的沸点 64.96℃,甲醛的沸点-21℃,甲醛的沸点更低的原因是分子间没有氢键。你认为甲醛分子间没有氢键的原因是 。
③甲醛分子σ键和π键的个数比为 。
(4)具有6 配位的Co3+的配合物[Co(NH3)mCln]Cl(3-n)具有一定的抗肿瘤活性。1 mol该配合物与足量AgNO3溶液反应生成2 mol AgCl沉淀,则m= 、n= 。
【化学一选修3:物质结构与性质】(15分)
(1)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、 (PAN)等二次污染物。
(PAN)等二次污染物。
①1mol PAN中含有的σ键数目为_______。PAN中除H外其余三种元素的第一电离能由大到小的顺序为_________________。
②NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中中心离子的配位数为_______,中心离子的核外电子排布式为_______________。
③相同压强下,HCOOH的沸点比CH3OCH3____(填“高”或“低”),其原因是___________________。
(2)PM2.5微细粒子包含(NH4)2SO4、NH4NO3等。
①(NH4)2SO4晶体中各种微粒间的作用力不涉及___________(填序号)。
a.离子键
b.共价键
c.配位键
d.范德华力
e.氢键
②NH4NO3中阳离子的空间构型为_____,阴离子的中心原子轨道采用_______杂化。
(3)测定大气中PM2.5的浓度方法之一是β—射线吸收法,β—射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子紧相邻的Kr原子有m个,晶胞中Kr原子为n个,则m/n=_____(填数字)。
【化学—选修3物质结构与性质】(1)A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(KJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
根据上述信息,写出B的基态原子核外电子排布式 ,预测A和氯元素形成的简单分子空间构型为 。
(2)钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,往其中一种配合物的溶液中加入AgNO3溶液时,无明显现象,往其溶液中加BaCl2溶液时若,产生白色沉淀,则该配合物的化学式为 ,中心离子的配位数为 。
(3)参考下表中的物质熔点回答下列问题
| 物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
| 熔点(℃) |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
根据上表数据解释钠的卤化物及碱金属的氯化物的熔点变化规律 。
(4)C60可用作储氢材料。C60的结构如图1。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体,该物质的K原子和C60分子的个数比为 。
(5)三聚氰胺分子的结构简式如图3,则其中氮原子轨道杂化类型是 ,l mol三聚氰胺分子中含 mol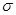 键。
键。
(6)碳化硅的晶胞与金刚石的晶胞相似如图4,设晶胞边长为a cm,碳原子直径为b cm,硅原子直径为c cm,则该晶胞的空间利用率为 (用含a、b、c的式子表示)。
原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为24。
(1)F原子基态的核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由大到小的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点远高于元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。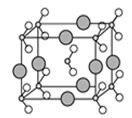
【化学—物质结构与性质】石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)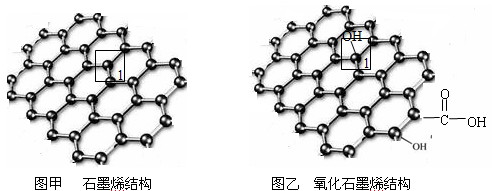
(1)图甲中,1号C与相邻C形成 键的个数为____________________________。
键的个数为____________________________。
(2)图乙中,1号C的杂化方式是________________,该C与相邻C形成的键角_______(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散到H2O中,则氧化石墨烯可与H2O形成氢键的原子有_________(填元素符号)。
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位于晶胞的棱上与内部,该晶胞中M原子的个数为_____________,该材料的化学式为__________。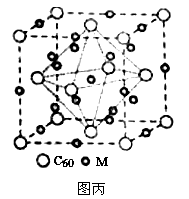
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为 ;
(2)用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜晶胞的体积是 cm3、晶胞的质量是 g,阿伏加德罗常数为 (列式计算,已知A1(Cu)=63.6);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 。已知其中一种化合物的化学式为KCuCl3,另一种化学式为 ;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是 ,反应的化学方程式为 。
选做[化学—选修3:物质结构与性质] (15分)X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)R核外电子排布式为__________________。
(2)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别为__________,ZW3-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是_____________(填化学式),原因是_________________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为______________________________________。
(5)W和Na的一种离子化合物的晶胞结构如图,该离子化合物为____________(填化学式)。Na+的配位数为_____________,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为__________。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则两个最近的W离子间距离为 nm(用含ρ、NA的计算式表示)。
[化学—选修3:物质结构与性质]Fe2+、Fe3+与O22—、CN—、F—、有机分子等形成的化合物具有广泛的应用。
(1)N、O、F三种元素原子的第一电离能由大到小的顺序是 。
(2)基态Fe3+核外M能层的电子排布式为 。
(3)铁有δ、γ、α三种同素异形体(如下图),则γ晶胞原子堆积名称为_____________。假设各种晶型的铁单质都是由半径为r的铁原子堆积而成,则晶胞δ与晶胞α的密度比为_______________(列式并化简)。
(4)乙酰基二茂铁是常用汽油抗震剂,其结构如图1所示。此物质中碳原子的杂化方式有 。
(5)配合物K3[Fe(CN)6]可用于电子传感器的制作。与配体互为等电子体的一种分子的电子式为 。已知(CN)2是直线形分子,并具有对称性,则(CN)2中π键和σ键的个数比为 。
(6)F—不仅可与Fe3+形成[FeF6]3—,还可以与Mg2+、K+形成一种立方晶系的离子晶体,此晶体应用于激光领域,结构如图2所示。该晶体的化学式为 。在该晶体中与一个F—距离最近且相等的F—的个数为 。
试题篮
()