某兴趣小组用合金铝、铁、铜的废弃合金为原料制取硝酸铜晶体和氢氧化铝,并测定硝酸铜晶体的结晶水含量和氢氧化铝的纯度,设计的主要流程如下:
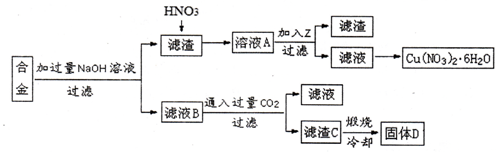
已知:Fe2+沉淀的pH范围为7.0~9.0;Fe3+沉淀的pH范围为1.9~3.2;Cu2+沉淀的pH范围为4.7~6.7。
(1)写出合金中加入NaOH溶液后所发生的离子反应方程式 。
(2)写出滤液B中通入过量CO2的化学方程式 。
(3)加入Z的作用是调节溶液的pH,除去溶液中的Fe3+,pH范围应为 ;下列可作为试剂z的是 。(填序号)
a.铜粉 b.氨水 c.氧化铜 d. 硫酸铜
(4)某同学为了测定硝酸铜晶体的结晶水含量,完成操作步骤:称量样品、加热、 、称量CuO质量、 、计算。
(5)滤渣C的质量是10g,煅烧后得到固体D6.90g,则滤渣C中氢氧化铝的质量分数为 。(保留两位小数)
(6)按该流程的操作步骤,氢氧化铝质量分数的测定结果偏高,可能的原因是 。(写一条即可)
铝、铁是重要的金属,其单质及化合物有着广泛的应用,完成下列填空:
(1)铝元素在周期表中的位置是 ,写出其最高价氧化物对应水化物的电离方程式 。
(2)画出铁原子的结构示意图 。与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为 。
(3)在FeC13稀溶液中滴加KSCN溶液后呈红色,反应的离子方程式是 ;在其中加入少量KCl固体,溶液的颜色 (选填“变深”,“变浅”或“不变”)。
(4)若先往FeCl3溶液中加入足量NaF溶液,再滴加溶液,则不呈红色,若再加入足够量FeC13溶液,又会呈现红色。请试对上述实验现象作出解释 。
为使溶液中的3种阳离子、A+、B2+、C3+逐一沉淀分离,将含有A+、B2+、C3+离子的水溶液进行如下实验,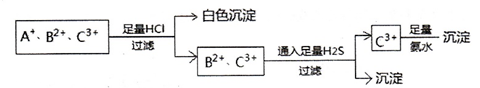
关于三种离子的判断正确的是
| A.Ag+、Fe2+、Al3+ | B.NH4+、Fe2+、Fe3+ | C.Ag+、Cu2+、Fe3+ | D.Ag+、Cu2+、A13+ |
某老师批阅学生实验报告,下列哪些学生是以科学的态度记录实验数据的
| A.甲学生用50mL量筒量取46.70mL浓盐酸 |
| B.乙学生用广泛pH试纸测定溶液的酸碱性:pH=14.5 |
| C.丙学生配NaOH溶液,用电子天平称取固体1.220g |
| D.丁学生用酸式滴定管量取25.00mL 0.1mol/L的盐酸 |
测定硫酸铜晶体(CuSO4·xH2O)中x值的实验过程如下。完成下列填空:
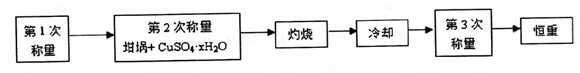
(1)设待测硫酸铜晶体的化学式为CuSO4·xH2O ,则该硫酸铜晶体受热失去全部结晶水的化学方程式为 。
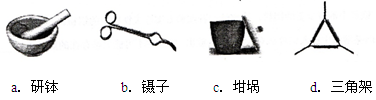
(2)下列是实验中用到的几种仪器,仪器与对应名称正确的是 。(填序号)
(3)“冷却”操作应在 (填仪器名称)中进行,“灼烧”时热源选用的是酒精灯而不是酒精喷灯,理由是 。
(4)恒重操作的目的是 。
(5)测定硫酸铜晶体结晶水含量时,若实验结果偏低,原因可能是 。(填序号)
a.坩埚未完全干燥 b.加热过程中晶体有少量溅失
c.坩埚上沾有受热不分解的杂质 d.加热后未放入干燥器中冷却
(6)下面是某学生实验的一次数据,请完成计算
| 加热前质量 |
加热后质量 |
||
| m1 |
m2 |
m3 |
m4 |
| 11.721g |
22.692g |
18.631g |
a |
①若无需再进行第三次称量,则a的数值范围应为 。
②若加热后坩埚与固体总质量为18.631g,实测值x= (保留两位小数)
③若理论值x=5,则该实验的相对误差是 。
铁、铝是应用最广泛的两种金属。完成下列填空:

(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,它们互称为 ,其中58Fe原子中子数与质子数之差为 。
(2)工业上可用铁槽车运输浓硫酸,是由于常温下浓硫酸能使铁 。
(3)野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。写出该反应的化学方程式 ,该反应是 (填“吸”或“放”)热反应。
(4)铁粉中混有少量的铝粉,请设计一种实验方案除去铁粉中的铝粉
(5)向某溶液中投入铝片后有大量的H2放出,溶液中不可能大量存在的离子是 (填序号)
a.Cl- b.H+ c.OH- d.HCO3-
(6)铁与稀硝酸反应的方程式如下:3Fe+8HNO3 →3Fe(NO3)2+2NO↑+4H2O
该反应的氧化剂是 ,氧化产物是 ,每转移1.8mol电子,生成NO L(标准状况)。
原子结构为 的元素,位于元素周期表的
的元素,位于元素周期表的
| A.第六周期第IV族 | B.第四周期第VI族 |
| C.第六周期第A族 | D.第四周期第VIA族 |
有A、B、C、D四种元素的离子A+、B2+、C- 、D2-,它们具有相同的电子数,下列判断中,正确的是
A.A、B、C、D四种元素可能属于同一周期
B.A、B、C、D四种元素一定属于短周期元素
C.原子序数由大到小的顺序是B>A>C>D
D.离子半径由大到小的顺序是、B2+>A+>C- >D2-
关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是
| A.原子半径:Na<Cl | B.热稳定性:HCl<HF |
| C.离子半径:F-<Mg2+ | D.碱性:NaOH<Mg(OH)2 |
无论在酸性溶液还是在碱性溶液中,一定都不能大量存在的离子是
| A.Al3+ | B.K+ | C.HS- | D.A1O2- |
锌片和铜片用导线连接后插入稀硫酸中可构成原电池,从原电池角度判断铜片是
| A.正极 | B.负极 | C.阴极 | D.阳极 |
深海中存在可燃冰(CH4·nH2O固体)。已知:CH4·nH2O(s) CH4(g)+nH2O(l)-Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的
CH4(g)+nH2O(l)-Q(Q>0)深海中能够存在可燃冰,是因为深海具有以下条件中的
| A.低温高压 | B.高温低压 | C.低温低压 | D.高温高压 |
下列各组微粒中,互为同素异形体的是
| A.H和D | B.O2和O3 |
| C.CH3CH2CH2CH3和(CH3)3CH | D.H2O和D2O |
试题篮
()