氨和水都是常用的试剂。请回答下列问题:
(1)氮元素在元素周期表中的位置是 ;基态氮原子的核外电子中,未成对电子数与成对电子数之比为____________。
(2)NH3分子可结合一个H+形成铵根离子(NH)。
①NH3分子中N原子的杂化类型是____________。
②NH3分子与H+结合的过程中未发生改变的是____________(填选项字母)。
A.微粒的空间结构 B.N原子的杂化类型 C.H—N—H的键角
(3)将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。[Cu(H2O)6]2+(水合铜离子)和[Cu(NH3)4]2+中共同含有的化学键类型是 。生成蓝色沉淀的离子方程式是 。
(1)右图是某化学反应中的能量变化图。
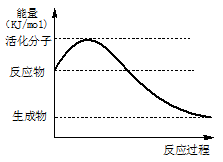
①该反应是 (填“吸热”或“放热”)反应。
②请在图中画出该反应的活化能E和反应热ΔH,并作相应标注。
③催化剂在实际生产中往往起关键作用,使用催化剂能改变反应速率的原因是。
(2)已知生成1mol H-H键,1molN-H键,1molN≡N键分别放出的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为______________。
(3)473K,101KPa时,把1mol H2和1mol I2放在某密闭容器中进行反应,热化学方程式如下:H2(g)+I2 (g) 2HI(g) ΔH=-14.9kJ/mol,测得反应放出的热量总是小于14.9kJ,其原因是 。
2HI(g) ΔH=-14.9kJ/mol,测得反应放出的热量总是小于14.9kJ,其原因是 。
H2S是一种无色、有臭鸡蛋气味、有毒的可燃性气体,高温下可以分解,其水溶液叫氢硫酸(二元弱酸,较强还原性)。
(1)用30% FeCl3溶液作吸收液能吸收H2S气体,反应方程式为:2FeCl3+H2S=S↓+2FeCl2+2HCl,废吸收液经电解可循环使用。
①该反应中H2S显 (填字母代号)。
a、不稳定性 b、弱酸性 c、氧化性 d、还原性
②检验废吸收液中是否含有Fe3+的适宜试剂是 ;反应的离子方程式是 。
③强酸性的废吸收液电解可生成FeCl3和一种分子量最小的气体,则该反应的化学方程式是 。
(2)已知:H2S在高温下分解生成硫蒸气和H2。现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如右图所示。

①表示H2的曲线是 (填“A”、“B”或“C”)。
②生成硫蒸气的分子式为 。
(1)将117 g NaCl溶于水配制成1 L溶液,该溶液中NaCl的物质的量浓度为 。
(2)在标准状况下,将V L A气体(摩尔质量为M)溶于0.1 L水中,所得溶液的密度为,则此溶液的物质的量浓度为 。
(3)某硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为 。
A.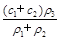 |
B.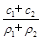 |
C.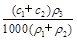 |
D.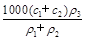 |
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系是
铝、铁的混合物溶于足量的盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加,将沉淀滤出并充分灼烧,得到的固体残留物恰好跟原混合物的质量相等,则此合金中铝的质量分数为
| A.22.2% | B.30.0% | C.75.7% | D.80.6% |
NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
| B.二氧化碳通过Na2O2粉末,反应后固体物质减轻 |
| C.1 mol Na2O2固体中含离子总数为4 NA |
| D.在过氧化钠与水的反应中,每生成0.1 mol氧气,转移电子的数目为0.4 NA |
常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是
| A.pH=12的Ba(OH)2 | B.pH=12的氨水 |
| C.0.05moL/L BaCl2 | D.0.01mol/L NaOH |
(1)甲醇是一种可再生能源,用途广泛,一种由甲醇、氧气以及强碱溶液制成的新型手机电池,容量达氢镍电池或锂电池的10倍。回答下列有关问题:

如图所示:
①甲池通入CH3OH的电极反应式为 ;乙池石墨一极的电极反应式为 ;
②反应一段时间后,向乙池中加入一定量 能使CuSO4溶液恢复到原浓度;
③甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生 g沉淀。
(2)工业上有一种生产甲醇的反应:
CO2(g) + 3H2(g) CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1
CH3OH(g) + H2O(g) △H=-49.0kJ·mol-1
在某温度下,容积均为2L的A、B两个容器中,按不同方式投入反应物,保持恒温恒容,经10秒钟后达到平衡,达到平衡时的有关数据如下表:
| 容器 |
A |
B |
| 反应物投入量 |
1mol CO2(g)和3mol H2(g) |
1mol CH3OH(g)和1mol H2O(g) |
| CH3OH(g)浓度(mol•L-1) |
c1 |
c2 |
| 反应能量变化 |
放出29.4kJ |
吸收akJ |
①从反应开始至达到平衡时,A中用CO2来表示的平均反应速率为 ;
②该温度下,反应CO2( ) + 3H2(
) + 3H2( )
) CH3OH(
CH3OH( ) + H2O(
) + H2O( ) 的化学平衡常数的值为 ;
) 的化学平衡常数的值为 ;
③a= 。
④下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入氢气
C.将水蒸气从体系中分离 D.用更有效的催化剂
根据下图填空:
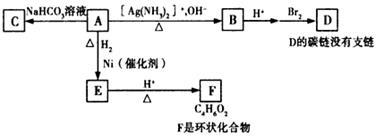
已知:1 mol A与2 mol H2反应生成1 mol E
(1)化合物A含有的官能团名称是 。
(2)B在酸性条件下与Br2反应得到D,写出D与足量NaOH溶液反应的化学方程式是 。
(3)与A具有相同官能团的A的同分异构体的结构简式是 。
(4)写出E的结构简式 。
(5)写出A→B的化学方程式 。
NA代表阿伏加德罗常数的值,下列说法正确的是
| A.含NA个N2和O2的混合气体中质子数不可能是15NA |
| B.1 L 1 mol·L-1的CH3COONa溶液中CH3COOH和CH3COO-的总数为NA |
| C.58g 分子式为C4H10的有机物中,所含有的甲基数一定为2NA |
| D.NA个CH4和NA个Cl2光照下充分反应,被取代的氢原子数为2NA |
某有机物(X)的结构简式如下图,下列关于它的说法不正确的是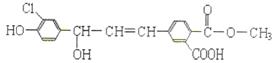
| A.X遇FeCl3溶液能发生显色反应 |
| B.一定条件下,X能发生取代、水解、氧化、加成、加聚、缩聚等反应 |
| C.1mol X分别与足量的NaOH、氢气反应,最多能消耗5mol NaOH 、7mol 氢气 |
| D.与等量X反应时,所需Na、NaHCO3、Na2CO3的最大量物质的量之比是3:1:1.5 |
下列物质在氢氧化钠溶液和加热条件下反应后生成的对应有机物中,能够被催化氧化成醛的是
| A.(CH3)2CHCl | B.CH3C(CH3)2I |
| C.(CH3)3COOCCH2CH3 | D.CH3C(CH3)2CH2Br |
草酸亚铁晶体(FeC2O4·2H2O)呈淡黄色。某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究。
(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成。这说明草酸亚铁晶体具有 _ (填“氧化性”、“还原性”或“碱性”)。若反应中消耗1 mol FeC2O4·2H2O,则参加反应的KMnO4为______ mol。
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体。课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;
假设二: ______ ;
假设三: ______。
(3)为验证上述假设一是否成立,课题组进行如下研究。
【定性研究】请你完成下表中内容。
| 实验步骤(不要求写出具体操作过程) |
预期实验现象和结论 |
| 取少量黑色固体,_________________ _________________________________ |
______________________________ ______________________________ |
【定量研究】课题组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示:

写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:__________________。
试题篮
()