常温下,H3PO4与NaOH溶液反应的体系中,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示[已知Ca3(PO4)2难溶于水]。下列有关说法不正确的是
| A.H3PO4的Ka3=10–12.2,HPO42–的水解平衡常数为10–6.8 |
| B.Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性 |
| C.为获得尽可能纯的NaH2PO4,pH应控制在4~5.5左右 |
| D.pH=13时,溶液中各微粒浓度大小关系为:c(Na+)>c(HPO42–)>c(PO43-)>c(OH-)>c(H+) |
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是
| A.b电极上的主反应是:SO32--2e-+H2O==SO42-+2H+ |
| B.若D是混合气体,则可能含有SO2、O2等成分 |
| C.a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体 |
| D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液 |
下列说法正确的是
| A.若高分子对应的单体只有一种,则此高聚物与单体有相同的最简式 |
| B.等物质的量的乙烯与乙醇充分燃烧时消耗氧气的质量不相等 |
| C.分子式为C6H12的某链状有机物,且6个碳原子肯定在同一平面上,则与氢气加成后产物的名称为:2,3一二甲基丁烷 |
D.有机物 的一种芳香族同分异构体能发生银镜反应 的一种芳香族同分异构体能发生银镜反应 |
【化学—选修5有机化学基础】酯类化合物在医药和涂料等应用广泛。
(1)某有机物X的结构简式如右图所示,则下列有关说法正确的是 (多选)
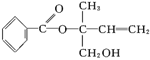
| A.X在一定条件下能发生加成反应、加聚反应和取代反应 |
| B.在Ni催化下,1 mol X最多只能与5 mol H2加成 |
| C.可用酸性高锰酸钾溶液区分苯和X |
| D.X核磁共振氢谱有10个吸收峰 |
(2)固定CO2能有效利用资源、减缓温室效应并制备某些酯类。某高分子F可用下列途径制得: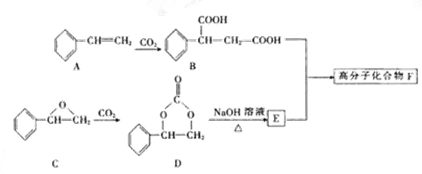
化合物A分子式为 ,1mol化合物A完全燃烧需要消耗 mol O2 。
(3)化合物A可由芳香族化合物Ⅰ或Ⅱ通过消去反应获得,但只有Ⅰ能与Na反应产生H2,则化合物Ⅰ的结构简式为 (任写一种);由化合物Ⅱ生成A的反应方程式是 。
(4)写出由D与足量NaOH溶液反应生成E的化学反应方程式: 。
(5)化合物E与B形成高分子化合物的反应方程式是:_______________。
【化学—选修2化学与技术】聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源、粉煤灰(主要成分为Al2O3、Fe2O3、FeO等)为铝源,制备PFAS的工艺流程如下:

(1)水是生命之源,水质优劣直接影响人体健康. 天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是 。水的净化与软化的区别是 。
(2)“碱溶”时,发生反应的化学方程式为 。“滤渣Ⅰ”成分是_________。
(3)“酸溶Ⅱ”时,可以产生Fe2+的反应的离子方程式为 。
(4)“氧化”时应控制在比较低的温度下进行,原因是 。
(5)“氧化”时若用ClO2代替,发生反应的离子方程式是 。
(14分)某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
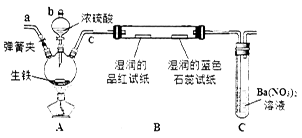
(1)按上图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称为________;实验过程中,装置B中观察的现象是_______________;装置C中有白色沉淀生成,该沉淀是______________(填化学式),原因是___________。
(2)装置A中还会产生CO2气体,请写出产生CO2的化学方程式:______________________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为 (填序号);装置②的作用是 ;③的作用是 ;然后再进行的操作是从a处多次鼓入N2,原因是_______________。
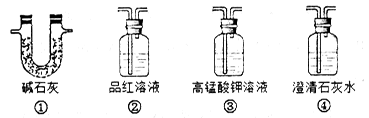
(4)某同学通过验证实验后期装置A中产生的气体中还含有H2,理由是________(用离子方程式表示)。
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.0.1 mol·L-1的醋酸与0.01 mol·L-1的醋酸相比,前者c(H+)大于后者的10倍 |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3-) +c(H+) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)>c(H+) |
| D.在25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,c(NH4+)=c(SO42-) |
下列有关实验装置(装置中略去支撑仪器)进行的相应实验,能达到实验目的的是

| A.用图1装置以NH4Cl为原料,装置③可用于制备NH3 |
| B.用图2所示装置可除去NO2中的NO |
| C.用图3所示装置比较KMnO4、Cl2、S的氧化性 |
| D.用图4装置制备Fe(OH)2并能较长时间观察其颜色 |
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是
| 选项 |
离子组 |
加入试剂(溶液) |
加入试剂后发生反应的离子方程式 |
| A |
SO42-、Fe2+、NO3-、K+ |
K3[Fe(CN)6] |
3Fe2++2[Fe(CN)6]2-=Fe3[Fe(CN)6]2↓ |
| B |
Na+、Fe3+、I-、ClO- |
HCl |
ClO-+H+=HClO |
| C |
Ba2+、Al3+、Cl-、H+ |
少量NaOH |
Al3++3OH-=Al(OH)3↓ |
| D |
S2O32+、Na+、Cl-、SO32-、K+ |
过量硫酸 |
2S2O32-+2H+=SO42-+3S↓+H2O |
选考【化学—选修5有机化学基础】萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下:

已知:
请回答下列问题:
(1)A所含官能团的名称是________________(写出两个中任意一个)。
(2)A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:
____________________________________________________________________。
(3)B的分子式为_________;写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。①核磁共振氢谱有2个吸收峰
②能发生银镜反应
(4)B → C、E → F的反应类型分别为_____________、_____________。
(5)C →D的化学方程式为______________________________________________。
(6)试剂Y的结构简式为______________________。
运用化学反应原理研究碳的化合物具有重要意义。
(1)常温下I2O5(s)可用于检测CO,反应原理为:5CO(g)+I2O5(s) 5CO2(g)+I2(s) △H<0。向2L密闭容器中加入足量I2O5(s),并通人1molCO,CO2的体积分数
5CO2(g)+I2(s) △H<0。向2L密闭容器中加入足量I2O5(s),并通人1molCO,CO2的体积分数 随时间的变化如下图所示:
随时间的变化如下图所示:
①0~0.5min内的平均反应速率v(CO)= _____________。
②保持温度和体积不变,若开始加入CO(g)的物质的量是原来的2倍,则下列说法正确的是______。
a.生成I2的质量为原来的2倍
b.混合气体的平均摩尔质量不变
c.达到平衡的时间为原来的2倍
d.混合气体的密度不变
③反应达a点时,欲增大容器中CO2的体积分数 ,可采取的措施为____________。
,可采取的措施为____________。
(2)以 为催化剂,可以将
为催化剂,可以将 的混合气体直接转化为乙酸。
的混合气体直接转化为乙酸。
①若该反应的原子利用率为100%,则 ______________。
______________。
②在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则: _____14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
_____14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)利用反应 可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
可以处理汽车尾气,若将该反应设计为原电池,用熔融Na2O作电解质,其正极电极反应式为________________________________。
(13分)金属冶炼和处理常涉及许多反应。
(1)下列有关金属的冶炼的说法正确的是( )
a.高炉炼铁的过程是通过置换反应得到的铁
b.用直接加热氧化铝的方法冶炼得到铝
c.高温加热氧化汞可以制单质汞
d.硫化亚铜与氧气反应炼制的过程属于氧化还原反应
(2)辉铜矿(Cu2S)可发生反应:2Cu2S + 2H2SO4 + 5O2 = 4CuSO4 + 2H2O
该反应的还原剂是______,当1molO2发生反应时,还原剂所失电子的物质的量为______mol。
(3)如图为电解精炼银的示意图,______(填a或b)极为含有杂质的粗银,若b极有少量红棕色气体生成,则生成该气体的电极反应式为 。

(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 ,其总反应式为: 。
(5)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g)
已知:①FeO(s) + CO(g) = Fe(s) + CO2(g) △H1=-11KJ/mol
②3Fe2O3(s) + CO(g) = 2Fe3O4(s) + CO2(g) △H2=-47KJ/mol
③Fe3O4(s) + CO(g) = 3FeO(s) + CO2(g) △H3=+19KJ/mol
则反应Fe2O3(s) + 3CO(g)= 2Fe(s)+ 3CO2(g)的△H= 。
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水。乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法不正确的是
| A.电解过程中,阴极附近的乙醛被氧化 |
| B.阳极反应CH3CHO-2e-+ H2O ="==" CH3COOH +2H+ |
| C.若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入CH4 |
| D.现处理含1mol乙醛的废水,至少需转移1mol电子 |
某无色溶液,溶质仅由Na+、Ag+、Ba2+、Al3+、AlO2─、MnO4─、CO32─、SO42─中的若干种组成。取该溶液进行如下实验:
⑴取适量溶液,加入过量盐酸,有气体生成,并得到无色溶液;
⑵在⑴所得溶液中加入过量溶液,有气体生成,同时析出白色沉淀甲;
⑶在⑵所得溶液中加入过量Ba(OH)2溶液并加热也有气体生成,同时析出白色沉淀乙。
则下列离子在原溶液中一定存在的有
| A.SO42-、AlO2─、Na+、CO32─ | B.Na+、CO32─、AlO2─ |
| C.CO32─、Na+、Al3+ | D.MnO4─、Na+、CO32─ |
硫酸锰在工业上广泛用于制电解猛、合成脂肪酸催化剂等。某科研小组利用软锰矿(主要成分为MnO2,同时含少量铁、铝等的化合物)制备硫酸锰晶体,其工艺流程如下:

部分金属阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
已知溶液的pH大于9时氢氧化铝又开始溶解。
请回答下列问题:
(1)焙烧时一般需要把矿石粉碎,矿石粉碎的目的是_______________;高温焙烧时在实验室宜选择的主要仪器是______________。
(2)酸浸、过滤后再向滤液中加入MnO2的目的是将溶液中的Fe2+氧化成Fe3+,该反应的离子方程式为 。
(3)在氧化的同时需要调节溶液的pH值,应调节pH的范围为 。滤渣A的成分除MnO2外,还有_______________。
(4)滤液得到产品的实验操作步骤为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。检验产品已洗涤干净的实验操作为______________________________。
(5)工业生产中为了确定需要向滤液中加入多少MnO2粉末,可准确量取10.00mL滤液用0.02mol/L酸性KMnO4溶液滴定,判断滴定终点的方法是 ;若达滴定终点共消耗10.00mL酸性KMnO4溶液,则滤液中Fe2+浓度是______________。
(6)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式为:
__________________________________。
试题篮
()