有A、B、C、D四种强电解质,它们在水中可电离出下列离子(每种物质只含一种阳离子和一种阴离子,且互不重复)。
| 阳离子 |
Na+、K+、Ba2+、NH4+ |
| 阴离子 |
SO42-、Cl-、OH-、CH3COO- |
已知:
①A、C溶液的pH均大于7,B溶液的pH小于7;D溶液焰色反应显黄色。
②C溶液与D溶液混合后生成白色沉淀;B溶液与C溶液混合后生成有刺激性气味的气体。
(1)B中阳离子是(填化学式) 。
(2)写出C溶液与D溶液反应的离子方程式: 。
⑶25℃时,pH=9的A溶液和pH=9的C溶液中水的电离程度小的是 (填A或C的化学式)。
⑷25℃时,用惰性电极电解 D 的水溶液,一段时间后溶液的pH_____7(填“>”、“<”或“=”)。
⑸将等体积等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为 。
⑹25℃时,在一定体积0.2 mol · L—1的C溶液中,加入一定体积的0.1 mol · L-1的盐酸时,混合溶液的pH=13。若反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是_ _
已知:①双键在链端的烯烃发生硼氢化-氧化反应,生成的醇羟基在链端:
化合物M是一种香料,可用如下路线合成:
已知:核磁共振氢谱显示E分子中有两种氢原子,F为芳香族化合物。请回答下列问题:
(1)原料C4H10的名称是 (用系统命名法);
(2)写出反应A→C的反应条件: ;
(3)F与新制Cu(OH)2反应的化学方程式 ;
(4)写出N、M的结构简式 、 ;
(5)写出与G具有相同官能团的G的所有芳香类同分异构体(不包括G本身)的结构简式:
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1)处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= 。若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
N2(g)+2CO2(g);△H<0。若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示,该反应的化学平衡常数为K= 。若保持温度不变,20min时再向容器中充入CO、N2各0.6mol,平衡将 移动(填“向左”、 “向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如图11所示的变化,则改变的条件可能是
(填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
(3)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式 。
(4)如图所示装置可用于制备N2O5,则生成N2O5的那一极电极反应式为 。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸_________________________________________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________(选填“是”或“否”)。混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________________
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是________________________________
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不用做近似计算)。
c(Na+)-c(A-)=________mol·L-1 c(OH-)-c(HA)=________mol·L-1
平衡指的是两个相反方向的变化最后所处的运动状态;在平衡时,两种变化仍在继续进行,但是它们的速率相等;根据变化的性质可分为物理平衡和化学平衡,中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等等。
(1)现有容积为1 L的恒温恒容密闭容器,向其中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g) C(g) △H=" -" a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
C(g) △H=" -" a kJ·mol-1,20s后,反应达到平衡状态,生成1 mol C气体,放出热量Q1kJ。回答下列问题。
①计算20s内B气体的平均化学反应速率为___________,写出该反应的平衡常数表达式___________。
②保持容器温度和容积不变,若改为向其中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是____________(填字母)。
(A)Q1 + Q2 = a (B) Q1 + 2Q2 < 2a (C)Q1 + 2Q2 > 2a (D)Q1 + Q2 < a
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入bmolA气体(b>0)时,v(正)_____v(逆)(填“>”、“<”或“=”),重新达平衡后,C气体的平衡体积分数 (C) =
(C) = 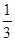 ,则b = ____________。
,则b = ____________。
(2)常温下,将VmL、0.1000mol·L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中,充分反应。回答下列问题。(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值_____20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为_____________________________________________。
②如果V=40.00,则此时溶液中c(OH-) -c(H+) - c(CH3COOH)= ___________________mol·L-1。
关于下列电解质溶液的说法中,正确的是
| A.常温下,10 mL 0.2mol/L NH4NO3溶液与10 mL 0.1mol/L NaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(NH4+)>c(Na+)>c(NH3·H2O)>c(OH-)>c(H+) |
| B.0.1 mol/LNa2S溶液中:c(Na+) + c(H+) = c(S2-) + c(HS-) + c(OH-) |
| C.常温下a mL 0.1 mol/L KOH与b mL 0.1 mol/L HCN两溶液混合后pH>7,则一定有a≥b |
| D.10 mL 0.1mol/L NaCl溶液中离子总数为x,10mL 0.1mol/LCH3COONa溶液中离子总数为y,则x>y |
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3)。
请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g) △H=-90.8 kJ·mol-1
CH3OH(g) △H=-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g) △H=-41.3 kJ·mol-1
CO2(g) + H2(g) △H=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的 △H=
CH3OCH3(g) + CO2 (g)的 △H=
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:
(填字母代号)。
a.压缩体积 b.加入催化剂
c.减少CO2的浓度 d.增加CO的浓度
e.分离出二甲醚(CH3OCH3)
(3)已知反应②:2CH3OH(g)  CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g) △H=-23.5 kJ·mol-1
某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| 浓度(mol·L-1) |
0.40 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小比较:v正 v逆(填“>”、“<”或“=”)。
②该反应的平衡常数的表达式为K= 温度升高,该反应的平衡常数K
(填“增大”、“减小”或“不变”)
某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
1根据下表中数据,在下图中画出X、Y、Z的物质的量n随时间t变化的曲线:
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
1.00 |
0.00 |
| 1 |
0.90 |
0.80 |
0.20 |
| 3 |
0.75 |
0.50 |
0.50 |
| 5 |
0.65 |
0.30 |
0.70 |
| 9 |
0.55 |
0.10 |
0.90 |
| 10 |
0.55 |
0.10 |
0.90 |
| 14 |
0.55 |
0.10 |
0.90 |
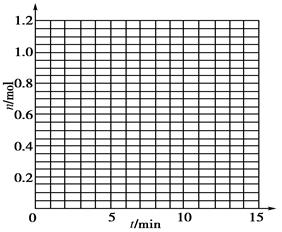
2体系中发生反应的化学方程式是_____________;
3列式计算该反应在0~3 min时间内产物Z的平均反应速率:______________________;
4该反应达到平衡时反应物X的转化率α等于________;
5如果该反应是放热反应。在该反应达到上述平衡状态时改变实验条件温度、压强、催化剂得到Z的物质的量(mol)随时间t(min)变化的曲线1、2、3如上右图所示则曲线1、2、3所对应的实验条件改变分别是:1______________,2______________,3______________。
某条件下,在2L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。
2NO(g)+O2(g) △H>0。在三种不同条件下进行,其中NO、O2的起始浓度都为0 mol/L,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。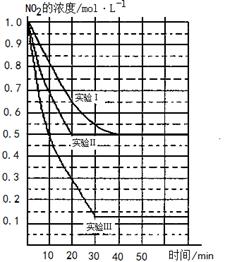
请回答下列问题:
(1)请在图中标上对应的反应温度(800℃或850℃)。实验Ⅱ隐含的反应条件是_______________________。
(2)写出该反应的平衡常数表达式:K=______________。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入1mol NO2与1mol NO混合气体(保持温度不变),则平衡将_________(填“正向移动”或“逆向移动”或“不移动”)
(4)一定条件下NO2与SO2可发生反应,其方程式为:
NO2(g)+SO2(g)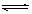 SO3(g)+NO(g) △H>0,将NO2与SO2以体积比
SO3(g)+NO(g) △H>0,将NO2与SO2以体积比 置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
A、体系压强保持不变 B、混合气体颜色保持不变
C、SO3和NO的体积比保持不变 D、混合气体的平均相对分子质量保持不变
(5)若改变条件,使平衡常数变大,该反应 。
A、一定向正反应方向移动 B、在平衡移动时,正反应速率先增大后减小
C、一定向逆反应方向移动 D、在平衡移动时,逆反应速率先增大后减小
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因: 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z气态氢化物的稳定性: > (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是 > > > 。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式: 。
(本题共10分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
已知:a:常见双原子单质分子中,X分子含共价键最多。
b:甲分子中含10个电子,乙分子中含有18个电子。
(1)X的结构式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备收集甲。
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填化学式)
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
。
④写出工业制甲的化学方程式 。
兔耳草醛H是一种重要的香料,主要用于食品、化妆品等工业中。用有机物A为原料可以合成兔耳草醛H,其合成路线如图所示:
中间产物D是一种精细化工产品,可用作香料,能发生如下反应:
已知:Ⅰ.已知:醛与二元醇(如乙二醇)可生成环状缩醛: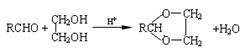
请回答:
(1)D的结构简式为 ,E中含有的官能团名称为 。
(2)A分子中碳、氢的质量比为12︰1,A的分子式为 ,B的结构简式为 。
(3)反应①的反应类型 , 反应②的化学方程式为 。
(4)兔耳草醛H中的含氧官能团易被氧化,生成化合物W, G与W可发生酯化反应,写出G与W反应的化学方程式
(5)W与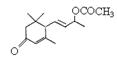 是否互为同分异构体 (填“是”或“否”),符合下列条件的
是否互为同分异构体 (填“是”或“否”),符合下列条件的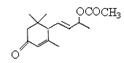 的同分异构体有 种,写出其中一种的结构简式 。
的同分异构体有 种,写出其中一种的结构简式 。
a.属于芳香族化合物且苯环上有五个取代基
b.核磁共振氢谱有四种类型氢原子的吸收峰
c.1mol该物质最多可消耗2molNaOH
d.能发生银镜反应
Na2O2是常见的氧化剂。某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物。
[实验步骤]
I.按下图所示装置组装仪器,并检查装置气密性。
Ⅱ.将0.6 g炭粉与3.9 g Na2O2均匀混合,装入试管,在靠近试管口处放置一张湿润的氯化钯试纸(湿润氯化钯试纸遇CO变黑,可用于检验是否有CO生成)。
Ⅲ. 用酒精灯微微加热试管底部。
[实验现象]
试管中发生剧烈反应并产生火花,氯化钯试纸未变黑,石灰水未变浑浊。
请回答:
(1)如何检查装置气密性____________________________________________________。
(2)装置B的作用是 。
(3)通过探究发现,装置A中发生的反应为2Na2O2+C Na2CO3 +X,X的电子式是 。
Na2CO3 +X,X的电子式是 。
(4)CO在潮湿环境中可将氯化钯还原为黑色粉末状的钯(Pd),同时生成另外两种物质。已知反应过程中转移6.02×l023个电子时,生成53 g Pd (已知Pd的相对原子质量为106),该反应的化学方程式为 _________________________________。
(5)将装置A中充分反应后所得产物溶于适量水中。
①所得溶液的溶质是 (填化学式)。
②溶液中下列关系正确的是 (填字母序号)。
③若使所得溶液与100 mL稀盐酸恰好完全反应至溶液pH =7(不考虑CO2的溶解),该盐酸的物质的量浓度为 。
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为( )
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
试题篮
()