晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度 线,计算出NaCl固体的体积为VmL。回答下列问题:
线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是_________________________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为a cm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。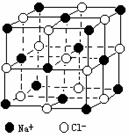
将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合溶液中并加热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系如图所示。
则原溶液中Al3+、Mg2+、NH4+的物质的量分别为 ( )
| A.2 mol、3 mol、8 mol | B.3 mol、2 mol、8 mol |
| C.2 mol、3 mol、4 mol | D.3 mol、2 mol、4 mol |
核磁共振造影增强剂用于疾病诊断,还可作为药物载体用于疾病的治疗。为磁性纳米晶体材料在生物医学领域的应用提供了更广泛的前景。制备纳米四氧化三铁过程如下:
下列有关叙述不合理的是:( )
| A.纳米四氧化三铁具有磁性作为药物载体用于疾病的治疗 |
| B.反应③的化学方程式是:6FeOOH+CO=2Fe3O4+3H2O+CO2 |
| C.纳米四氧化三铁分散在适当溶剂中,它与溶液分散质直径相当 |
| D.在反应②环丙胺的作用可能是促进氯化铁水解 |
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)As2S3和HNO3有如下反应,As2S3+10H++ 10NO3—="2H3AsO4+" 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(3)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5mol c.大于0.5mol d.无法确定
金刚烷是一种重要的化工原料,工业上可通过下列途径制备:
请回答下列问题:(1) 环戊二烯分子中最多有____ ________个原子共平面;
________个原子共平面;
(2) 金刚烷的分子式为_______________,其分子中的CH2基团有_____________个;
(3) 下面是以环戊烷为原料制备环戊二烯的合成路线:
其中,反应②的反应试剂和反应条件_____________,反应③的反应类型是___________;
(4)A是二聚环 戊二烯的同分异构体,A分子结构中有一个甲基,A能使溴的四氯化碳溶液褪色,
戊二烯的同分异构体,A分子结构中有一个甲基,A能使溴的四氯化碳溶液褪色, A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸【提示:苯环上的烷基(一CH3,一CH2R,一CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基】,写出A所有可能的结构简式(不考虑立体异构):
A经高锰酸钾酸性溶液加热氧化可以得到对苯二甲酸【提示:苯环上的烷基(一CH3,一CH2R,一CHR2)或烯基侧链经高锰酸钾酸性溶液氧化得羧基】,写出A所有可能的结构简式(不考虑立体异构):
含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
| A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl- |
| B.x=0.6a,2Br-+ Cl2=Br2+2Cl- |
| C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl- |
| D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl- |
图表法、图象法是常用的科学研究方法。
下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A |
B[ |
C |
D |
E |
F |
G |
H |
I |
J |
| 原子半径(10-10m) |
1.02 |
2.27 |
0.74 |
1.43 |
0.77 |
1.10 |
0.99 |
1.86 |
0.75 |
1.17 |
| 最高价态 |
+6 |
+1 |
— |
+3 |
+4 |
+5 |
+7 |
+1 |
+5 |
+4 |
| 最低价态 |
-2 |
— |
-2 |
— |
-4 |
-3 |
-1 |
— |
-3 |
-4 |
试回答下列问题:
(1)已知H为Na元素,则以上10种元素中第一电离能最小的是: (填编号)。比元素B原子序数大10的元素其基态原子的核外电子排布是  。
。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出一种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是 。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其一分子中共形
成 个σ键, 个π键。
个σ键, 个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。
则K元素位于周期表的第 族。
图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。
不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线—折线a和折线b,你认为正确的是 ,理由是
随着人们日常生活水平的提高,室内空气污染越来越受到人们的重视。造成室内环境污染的有毒物质主要有甲醛、苯、氨、氡、一氧化碳等物质。
请回答下列问题:
⑴苯分子的结构简式为 。
⑵我国《室内空气质量标准》规定室内空气中甲醛(HCHO)含量不得超过0.08mg/m3。某校化学研究性学习小组的同学通过查阅资料,拟采用如下方法测定某新装修居室内空气中甲醛的含量。
测定原理:5HCHO+4KMnO4+6H2SO4=2K2SO4+4MnSO4+5CO2↑+11H2O
实验操作:用容积为1000 mL的医用注射器抽取空气,缓慢注入酸性高锰酸钾溶液中(装置如下),当酸性高锰酸钾溶液正好褪色时,停止注入。
①用0.1000mol/L的酸性KMnO4溶液配制实验中使用的酸性KMnO4溶液1000mL,需0.1000mol/L的酸性KMnO4溶液的体积为 。
②向酸性高锰酸钾溶液中注入空气前,应检查吸收器装置气密性,操作方法为 ;装置中多孔玻璃球的作用是 。
③实验时在居室内不同地点抽取空气,并缓慢注入酸性高锰酸钾溶液中。当第200次将注射器中空气全部缓慢注入酸性高锰酸钾溶液中时,酸性高锰酸钾溶液正好褪色。请通过计算说明该居室空气中甲醛含量是否超标(空气中其他成分不与酸性高锰酸钾溶液反应)。
④请你举出减少室内空气污染的一条合理措施: 。
一定温度下,分别往容积均为5L的甲(恒容容器)、乙(恒压容器)中加入0.5mol无色的N2O4气体,立即出现红棕色。当反应进行到2s时,测得甲容器中N2O4的浓度为0.09mol/L。经过60s,甲容器中的反应达到平衡。(反应过程中两个容器的温度均保持恒定)
(1)容器中气体出现红棕色的原因(用化学方程式表示)
________________________________________________;
(2) 达到平衡时,乙容器中反应所需的时间______60s(填“>”、“<”或“=”,以下同);容器内N2O4的浓度甲__________乙;反应过程中吸收的能量甲_________乙。
(3)若要使甲、乙中N2O4的浓度相等,不能采取的措施是__________(填选项的标号)
A.保持温度不变,适当缩小乙容器的体积
B.保持容器体积不变,使乙容器升温
C.保持容器体积和温度不变,向乙容器中加入适量N2O4
一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
| A.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大 |
B.保持温度和活塞位置不变,在甲中 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 |
| C.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
D.保持温度不变,移动活塞 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
X、Z、Q、R 4种短周期元素原子序数的依次增大,Y是一种短周期主族非金属元素。化合物甲由X、Z、Q 3种元素组成,常温下,0.1mol·L-1甲溶液的pH=13。工业上常用电解QR饱和溶液生产甲。请填写下列空白。
(1)Q的原子结构示意图为 。
(2)电解QR饱和溶液反应的离子方程式为 。
(3)常温下将R的单质通入甲溶液中,发生反应的离子方程式为 。
(4)①若Y与X组成的气体化合物乙在常温下遇XR气体时产生白烟,则乙的化学式为 ;YZ2与水反应的化学方程式:________________________________________
②若Y元素的单质能发生如图所示转化,则Y元素名称是 。YZ2的结构式为:_____________YZ2通过置换反应可生成Y的单质,该反应式为:____________________________________
③若Y元素的单质是一种淡黄色固体。写出Y的最高价氧化物的水化物的浓溶液与铜共热的化学方程式:______________ ____________________________________
④若Y的最高价氧化物可制光导纤维。写出工业生产Y单质的反应的化学方程式:____________________________________________________________
(18分)甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性己检验)。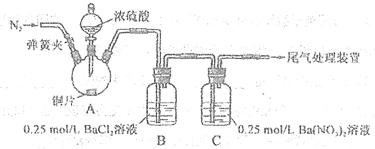
实验操作和现象: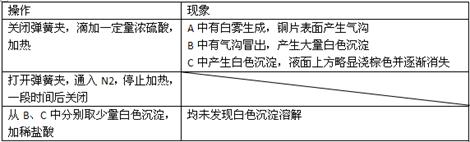
(1)A中反应的化学方程式是 。
(2)C中白色沉淀是 ,该沉淀的生成表明SO2,具有 性。
(3)C中液面上方生成浅棕色气体的化学方程式是 。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气参与反应,乙同学认为
是白雾参与反应。
①为证实各自的观点,在原实验基础上/甲同学在原有操作之前增加一步操作,该操作是
;乙同学在A、B间增加洗气瓶D,D
中盛放的试剂是 。
②甲、乙两同学分别改进实验后,B装置中现象分别为:
| 甲 |
大量白色沉淀 |
| 乙 |
少量白色沉淀 |
检验白色沉淀,发现均不溶于稀盐酸。请用离子方程式解释甲、乙两同学改进实验后仍然产生沉淀的原因,甲: ,乙: 。
(5)合并(4)中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是 。
A~H有如图所示的转化关系,其中A是盐,B、C、D、E、F在常温常压下均是气态物质,反应④、⑤均在溶液中进行,转化中反应条件略去。
试回答下列问题:
(1)物质A的化学式为 ,电解时阴极反应式为 .
(2)反应③的化学方程式为 。
(3)反应⑤的离子方程式为 。
(4)镁与铝能形成多种合金,为了确定某合金样品的成分,小明同学设计如图所示的实验步 骤,确定合金组成。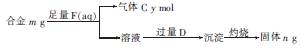
①能确定合金组成的数据组有 (填字母)。
a.m、n b.m、y c.n、y
②若合金中Mg的物质的量分数为x,金属总物质的量为7 mol,试在图中作出y随x变化的曲线。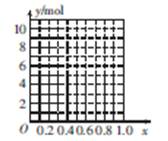
新型陶瓷氮化铝可用Al2O3高温还原法制备: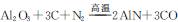 ,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。
,用该法制得的产品中常含有少量杂质。某同学拟通过下列实验装置测定产品中AIN的纯度。
已知:AIN溶于强碱时会生成NH3。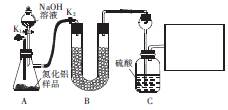
(1)从原料角度分析,AIN中的杂质可能是 ,装置A中产生气体的化学方程式为 。
(2)装置B中的试剂是____;装置C中长颈漏斗的作用是 。
在上图右边的方框中,画出所缺装置图,并注明装置中的试剂。
(3)充分反应后,需打开K1,通入一段时间N2,其目的是 。
(4)若样品的质量为mg,实验前后装置C增重ng,则样品中AIN昀纯度为 。
向含有1 mol HNO3和1mol H2SO4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离子a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是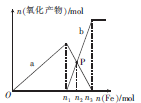
| A.a表示Fe3+的关系曲线 |
| B.n1=0.75 |
| C.P点时,n(Fe2+)="0.5625" mol |
| D.向P点溶液中加入铜粉,最多可溶解14.4 g |
试题篮
()