二氧化碳加氢制甲烷过程中的主要反应为
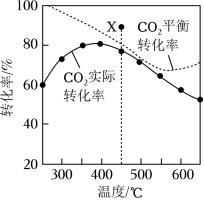
在密闭容器中, 、 时, 平衡转化率、在催化剂作用下反应相同时间所测得的 实际转化率随温度的变化如题图所示。 的选择性可表示为 。下列说法正确的是( )
| A. |
反应 的焓变 |
| B. |
的平衡选择性随着温度的升高而增加 |
| C. |
用该催化剂催化二氧化碳反应的最佳温度范围约为 |
| D. |
时,提高 的值或增大压强,均能使 平衡转化率达到 点的值 |
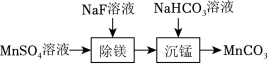
室温下,用含少量 的MnSO4溶液制备 的过程如题图所示。已知 , 。下列说法正确的是( )
| A. |
溶液中: |
| B. |
“除镁”得到的上层清液中: |
| C. |
溶液中: |
| D. |
“沉锰”后的滤液中: |
室温下,探究 溶液的性质,下列实验方案能达到探究目的的是( )
|
选项 |
探究目的 |
实验方案 |
|
A |
溶液中是否含有 |
向 溶液中滴加几滴新制氯水,再滴加 溶液,观察溶液颜色变化 |
|
B |
是否有还原性 |
向 溶液中滴加几滴酸性 溶液,观察溶液颜色变化 |
|
C |
是否水解 |
向 溶液中滴加 滴酚酞试液,观察溶液颜色变化 |
|
D |
能否催化 分解 |
向 溶液中滴加几滴 溶液,观察气泡产生情况 |
| A. |
A |
B. |
B |
C. |
C |
D. |
D |
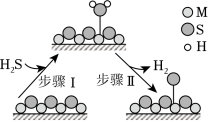
金属硫化物( )催化反应 ,既可以除去天然气中的 ,又可以获得 。下列说法正确的是( )
| A. |
该反应的 |
| B. |
该反应的平衡常数 |
| C. |
题图所示的反应机理中,步骤Ⅰ可理解为 中带部分负电荷的 与催化剂中的 之间发生作用 |
| D. |
该反应中每消耗 ,转移电子的数目约为 |
化合物 是合成药物非奈利酮的重要中间体,其合成路线如图:

下列说法正确的是( )
| A. |
不能与 溶液发生显色反应 |
| B. |
中的含氧官能团分别是酯基、羧基 |
| C. |
最多能与 发生加成反应 |
| D. |
可用饱和 溶液和 银氨溶液进行鉴别 |
氮及其化合物的转化具有重要应用。下列说法不正确的是( )
| A. |
实验室探究稀硝酸与铜反应的气态产物:
(稀) |
| B. |
工业制硝酸过程中的物质转化:
|
| C. |
汽车尾气催化转化器中发生的主要反应:
|
| D. |
实验室制备少量
的原理:
|
阅读下列材料,完成下面小题。
氢元素及其化合物在自然界广泛存在且具有重要应用。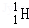 、
、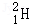 、
、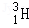 是氢元素的3种核素,基态
原子
的核外电子排布,使得
既可以形成
又可以形成
,还能形成
等重要化合物;水煤气法、电解水、光催化分解水都能获得
,如水煤气法制氢反应中,
与足量
反应生成
和
吸收
的热量。
在金属冶炼、新能源开发、碳中和等方面具有重要应用,如
在催化剂作用下与
反应可得到
。我国科学家在氢气的制备和应用等方面都取得了重大成果。
是氢元素的3种核素,基态
原子
的核外电子排布,使得
既可以形成
又可以形成
,还能形成
等重要化合物;水煤气法、电解水、光催化分解水都能获得
,如水煤气法制氢反应中,
与足量
反应生成
和
吸收
的热量。
在金属冶炼、新能源开发、碳中和等方面具有重要应用,如
在催化剂作用下与
反应可得到
。我国科学家在氢气的制备和应用等方面都取得了重大成果。
(1)下列说法正确的是( )
| A. |
|
| B. |
和 的中心原子轨道杂化类型均为 |
| C. |
分子中的化学键均为极性共价键 |
| D. |
晶体中存在 与 之间的强烈相互作用 |
(2)下列化学反应表示正确的是( )
| A. |
水煤气法制氢: |
| B. |
催化加氢生成
的反应:
|
| C. |
电解水制氢的阳极反应: |
| D. |
与水反应: |
(3)下列物质结构与性质或物质性质与用途具有对应关系的是( )
| A. |
具有还原性,可作为氢氧燃料电池的燃料 |
| B. |
氨极易溶于水,液氨可用作制冷剂 |
| C. |
分子之间形成氢键, 的热稳定性比 的高 |
| D. |
中的 原子与 形成配位键, 具有还原性 |
元素 位于周期表中 族。下列说法正确的是( )
| A. |
原子半径: |
| B. |
第一电离能: |
| C. |
碳单质、晶体硅、 均为共价晶体 |
| D. |
可在周期表中元素 附近寻找新半导体材料 |
实验室制取 的实验原理及装置均正确的是( )
| A. |
|
B. |
|
| C. |
|
D. |
|
反应 应用于石油开采。下列说法正确的是( )
| A. |
的电子式为 |
| B. |
中N元素的化合价为 |
| C. |
分子中存在 键 |
| D. |
为非极性分子 |
我国提出2060年实现碳中和的目标,体现了大国担当。碳中和中的碳是指( )
| A. |
碳原子 |
B. |
二氧化碳 |
C. |
碳元素 |
D. |
含碳物质 |
是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某 (Ⅱ)催化剂{用 表示}能高效电催化氧化 合成 ,其反应机理如图所示。下列说法错误的是( )
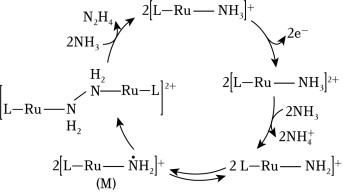
| A. |
(Ⅱ)被氧化至 (Ⅲ)后,配体 失去质子能力增强 |
| B. |
中 的化合价为 |
| C. |
该过程有非极性键的形成 |
| D. |
该过程的总反应式: |
向一恒容密闭容器中加入 和一定量的 ,发生反应: 。 的平衡转化率按不同投料比 随温度的变化曲线如图所示。下列说法错误的是( )
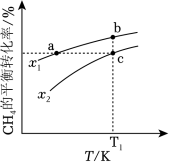
| A. |
|
| B. |
反应速率: |
| C. |
点 对应的平衡常数: |
| D. |
反应温度为 ,当容器内压强不变时,反应达到平衡状态 |
常温下,用浓度为 的 标准溶液滴定浓度均为 的 和 的混合溶液,滴定过程中溶液的 随 ( )的变化曲线如图所示。下列说法错误的是( )
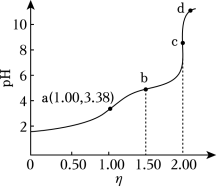
| A. |
约为 |
| B. |
点 : |
| C. |
点 : |
| D. |
水的电离程度: |
试题篮
()