砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等.回答下列问题:
(1)写出基态As原子的核外电子排布式________.
(2)根据元素周期律,原子半径Ga________As,第一电离能Ga________As.(填"大于"或"小于")
(3) AsCl3 分子的立体构型为________,其中As的杂化轨道类型为________.
(4) GaF3 的熔点高于1000℃, GaCl3 的熔点为77.9℃,其原因是________.
(5)GaAs的熔点为1238℃,密度为 ρg•cm﹣3 , 其晶胞结构如图所示.
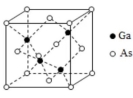
该晶体的类型为________,Ga与As以________键键合.Ga和As的摩尔质量分别为 MGag•mol﹣1 和 MAsg•mol﹣1 , 原子半径分别为 rGapm 和 rAspm ,阿伏伽德罗常数值为 NA ,则GaAs晶胞中原子的体积占晶胞体积的百分率为________.
天然气的主要成分为CH 4,一般还含有C 2H 6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C 2H 6(g)═C 2H 4(g)+H 2(g)△H 1,相关物质的燃烧热数据如下表所示:
| 物质 |
C 2H 6(g) |
C 2H 4(g) |
H 2(g) |
| 燃烧热△H/(kJ•mol ﹣ 1) |
﹣1560 |
﹣1411 |
﹣286 |
①△H 1= kJ•mol ﹣ 1。
②提高该反应平衡转化率的方法有 、 。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α.反应的平衡常数K p= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH 4 高温→ C 2H 6+H 2.反应在初期阶段的速率方程为:r=k×c CH4 ,其中k为反应速率常数。
①设反应开始时的反应速率为r 1,甲烷的转化率为α时的反应速率为r 2,则r 2= r 1。
②对于处于初期阶段的该反应,下列说法正确的是 。
A.增加甲烷浓度,r增大
B.增加H 2浓度,r增大
C.乙烷的生成速率逐渐增大
D.降低反应温度,k减小
(3)CH 4和CO 2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
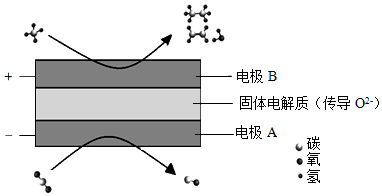
①阴极上的反应式为 。
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH 4和CO 2体积比为 。
氢气的生产、存储是氢能应用的核心。目前较成熟的生产、存储路线之一为:利用CH 3OH和H 2O在某Cu/Zn﹣Al催化剂存在下生产H 2,H 2与Mg在一定条件下制得储氢物质X。
回答问题:
(1)Al在周期表中的位置 。基态Zn的价层电子排布式 。
(2)水分子中氧原子的杂化轨道类型 。
(3)键能是衡量共价键稳定性的参数之一。 CH 3OH键参数中有 种键能数据。CH 3OH可以与水以任意比例互溶的原因是 。
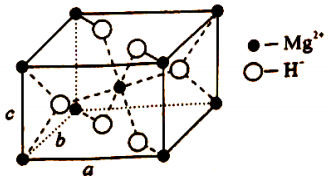
(4)X的晶胞结构如图所示(晶胞参数:α=β=γ=90°,a=b=450.25pm),密度为1.4g•cm ﹣ 3,H ﹣的配位数为 ,X的储氢质量分数是 ,c= pm (列出计算式即可)。
吸热反应N2(g)+O2(g) 2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
2NO(g),在2000℃时K=6.2×10-4。2000℃时,向10L密闭容器中放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2。
通过计算回答:
(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行以达到化学平衡状态?
把3.9 g Na2O2放入100mL水中,充分反应后,计算:
(1)生成O2的体积(标准状况);
(2)反应后所得NaOH的物质的量浓度(反应前后溶液体积变化忽略不计)。
实验室常用MnO2与浓盐酸加热制备Cl2,反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,某小组同学提出的下列实验方案:向足量的二氧化锰中加入12.0mL的浓盐酸,加热,反应结束时收集到336mLCl2(标准状况);将反应后得到的残余液过滤、洗涤滤渣,洗涤液和滤液混合;向滤液中加入足量的AgNO3溶液,过滤、洗涤、干燥后得到固体11.48g。计算
(1)参加反应的二氧化锰的质量。
(2)将生成的Cl2通到NaOH溶液中制得100mL消毒液,求消毒液中有效成分的物质的量浓度。
(3)浓盐酸能和二氧化锰反应的生成Cl2的最低浓度(假设反应后残余液体积为12mL)。(保留至0.01)
把10.2g镁铝合金的粉末放入过量的盐酸中,得到11.2L H2(标准状况下).试计算(写出计算过程):
(1)该合金中铝的质量分数;
(2)该合金中铝和镁的物质的量之比.
把5.1 g镁铝合金的粉末放入过量的300 mL 2 mol·L-1盐酸中,得到5.6 L H2(标准状况下)。试计算:
(1)该合金中铝和镁的物质的量之比。
(2)在反应后的溶液中加入4 mol·L-1 NaOH溶液,若要使沉淀量达到最大值,则加入的NaOH溶液的体积为多少?
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2。850℃~950℃时,空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):4FeS2+11O2→2Fe2O3+8SO2
(1)含硫35%的硫铁矿样品(杂质不含硫),其FeS2的含量为 。
(2)设1t纯净的FeS2完全反应,产生标准状况下SO2 m3。
(3)为使FeS2煅烧完全生成Fe2O3,工业上使用过量空气,当空气过量20%时,所得炉气中SO2的体积分数为多少?
一氯代烃A(C5H11Cl)经水解后再氧化可得到有机物B,A的一种同系物(C4H9Cl)经水解得到有机物C,B和C可发生酯化反应生成酯D,则D可能的结构有种
| A.12 | B.16 | C.24 | D.32 |
将0.1mol某烃的衍生物与标准状况下4.48L氧气混合密闭于一容器中,点火后发生不完全燃烧,得到CO2、CO和H2O的气态混合物。将混合气体通过浓硫酸时,浓硫酸质量增加了3.6g,通过澄清石灰水时,可得到沉淀10g (干燥后称量)。剩余气体与灼热的氧化铁充分反应后再通入澄清的石灰水中,又得到20g固体物质(干燥后)。
求:(1)该有机物的分子式。
(2)该有机物可与醇发生酯化反应,且可使溴水褪色,写出有机物的结构式。
计算题(写出解题过程)
一定质量的金属铜,加入50mL10mol/L的浓硝酸充分反应后,铜完全溶解,共放出标准状况下的气体4.48L。
(1)若气体只有NO2,计算铜的质量。
(2)若气体为NO2和NO,且硝酸也恰好完全反应,计算铜的质量。
将6g的铁粉加入200mL Fe2(SO4)3和CuSO4的混合溶液,充分反应得到200mL 0.5mol/LFeSO4溶液和5.2g固体沉淀物。试计算
(1)反应后生成铜的质量;
(2)原Fe2(SO4)3溶液的物质的量浓度。
将20g某铁矿石(设只含铁的氧化物和杂质SiO2)溶于过量的稀盐酸,过滤后得5.6g不溶物和滤液;然后在滤液中加入足量的NaOH溶液,过滤后将沉淀灼烧,得16g红棕色固体。
(1)红棕色固体的化学式是 ,其中的n(Fe)= mol。
(2)请计算(写出计算过程):
①该矿石中铁氧化物的化学式。
②若加入的稀盐酸为4.0mol·L -1200mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是多少?
试题篮
()