实验室模拟“镁法工业烟气脱硫”并制备 MgSO4•H2O,其实验过程可表示为
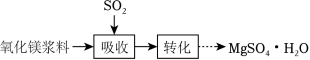
(1)在搅拌下向氧化镁浆料中匀速缓慢通入 SO2气体,生成 MgSO3,反应为 Mg(OH)2+H2SO3═MgSO3+2H2O,其平衡常数 K与 Ksp[Mg(OH)2]、Ksp(MgSO3)、Ka1(H2SO3)、Ka2(H2SO3)的代数关系式为 K=__________;下列实验操作一定能提高氧化镁浆料吸收 SO2效率的有_____(填序号)。
| A. |
水浴加热氧化镁浆料 |
| B. |
加快搅拌速率 |
| C. |
降低通入 SO2气体的速率 |
| D. |
通过多孔球泡向氧化镁浆料中通 SO2 |
(2)在催化剂作用下 MgSO3被 O2氧化为 MgSO4。已知 MgSO3的溶解度为 0.57g(20℃), O2氧化溶液中 SO32-的离子方程式为__________;在其他条件相同时,以负载钴的分子筛为催化剂,浆料中 MgSO3被 O2氧化的速率随 pH的变化如题图甲所示。在 pH=6~8范围内,pH增大,浆料中 MgSO3的氧化速率增大,其主要原因是__________。
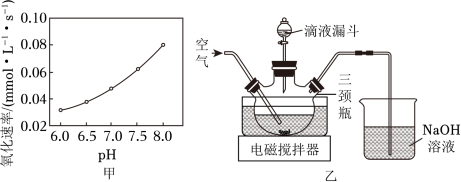
(3)制取 MgSO4•H2O晶体。在如题图乙所示的实验装置中,搅拌下,使一定量的 MgSO3浆料与 H2SO4溶液充分反应。 MgSO3浆料与 H2SO4溶液的加料方式是__________;补充完整制取 MgSO4•H2O晶体的实验方案:向含有少量 Fe3+、Al3+的 MgSO4溶液中,_______________。(已知: Fe3+、Al3+在 pH≥5时完全转化为氢氧化物沉淀;室温下从 MgSO4饱和溶液中结晶出 MgSO4•7H2O, MgSO4•7H2O在 150~170℃下干燥得到 MgSO4•H2O,实验中需要使用 MgO粉末)
V2O5﹣WO3/TiO2催化剂能催化 NH3脱除烟气中的 NO,反应为 4NH3(g)+O2(g)+4NO(g)═4N2(g)+6H2O(g)ΔH=﹣1632.4kJ•mol﹣1。
(1)催化剂的制备。将预先制备的一定量的 WO3/TiO2粉末置于 80℃的水中,在搅拌下加入一定量的 NH4VO3溶液,经蒸发、焙烧等工序得到颗粒状 V2O5﹣WO3/TiO2催化剂。在水溶液中 VO3-水解为 H3VO4沉淀的离子方程式为__________;反应选用 NH4VO3溶液而不选用 NaVO3溶液的原因是__________。
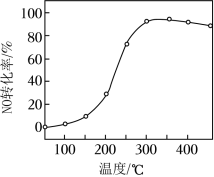
(2)催化剂的应用。将一定物质的量浓度的 NO、O2、NH3(其余为 N2)气体匀速通过装有 V2O5﹣WO3/TiO2催化剂的反应器,测得 NO的转化率随温度的变化如题图所示。反应温度在 320~360℃范围内, NO转化率随温度变化不明显的原因是__________;反应温度高于 380℃, NO转化率下降,除因为进入反应器的 NO被还原的量减少外,还有__________(用化学方程式表示)。
(3)废催化剂的回收。回收 V2O5﹣WO3/TiO2废催化剂并制备 NH4VO3的过程可表示为
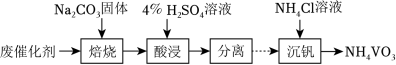
①酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有__________。
②通过萃取可分离钒和钨,在得到的钒酸中含有 H4V4O12。已知 H4V4O12具有八元环结构,其结构式可表示为__________。
③向 pH=8的 NaVO3溶液中加入过量的 NH4Cl溶液,生成 NH4VO3沉淀。已知: Ksp(NH4VO3)=1.7×10﹣3,加过量 NH4Cl溶液的目的是__________。
超纯 Ga(CH3)3是制备第三代半导体的支撑源材料之一,近年来,我国科技工作者开发了超纯纯化、超纯分析和超纯灌装一系列高新技术,在研制超纯 Ga(CH3)3方面取得了显著成果,工业上以粗镓为原料,制备超纯 Ga(CH3)3的工艺流程如图:

知:①金属 Ga的化学性质和 Al相似, Ga的熔点为 29.8℃;
② Et2O(乙醚)和 NR3(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
|
物质 |
Ga(CH3)3 |
Et2O |
CH3I |
NR3 |
|
沸点/ ℃ |
55.7 |
34.6 |
42.4 |
365.8 |
回答下列问题:
(1)晶体 Ga(CH3)3的晶体类型是_____;
(2)“电解精炼”装置如图所示,电解池温度控制在 40~45℃的原因是__________,阴极的电极反应式为_____;

(3)“合成 Ga(CH3)3(Et2O)”工序中的产物还包括 MgI2和 CH3MgI,写出该反应的化学方程式_______________;
(4)“残渣”经纯水处理,能产生可燃性气体,该气体主要成分是_____;
(5)下列说法错误的是_____;
A.流程中 Et2O得到了循环利用
B.流程中,“合成 Ga2Mg5”至“工序 X”需在无水无氧的条件下进行
C.“工序 X”的作用是解配 Ga(CH3)3(NR3),并蒸出 Ga(CH3)3
D.用核磁共振氢谱不能区分 Ga(CH3)3和 CH3I
(6)直接分解 Ga(CH3)3(Et2O)不能制备超纯 Ga(CH3)3,而本流程采用“配体交换”工艺制备超纯 Ga(CH3)3的理由是 ____________________;
(7)比较分子中的 C﹣Ga﹣C键角大小: Ga(CH3)3 _____ Ga(CH3)3(Et2O)(填“>”“<”或“=”),其原因是__________。
聚苯乙烯是一类重要的高分子材料,可通过苯乙烯聚合制得。
Ⅰ.苯乙烯的制备
(1)已知下列反应的热化学方程式:
① C6H5C2H5(g)+212
②
③
计算反应④ _____ ;
(2)在某温度、 下,向反应器中充入 气态乙苯发生反应④,其平衡转化率为 ,欲将平衡转化率提高至 ,需要向反应器中充入_____ 水蒸气作为稀释气(计算时忽略副反应);
(3)在 下,以水蒸气作稀释气、 作催化剂,乙苯除脱氢生成苯乙烯外,还会发生如下两个副反应:
⑤
⑥
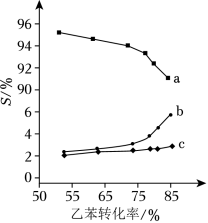
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性 ( )随乙苯转化率的变化曲线如图所示,其中曲线 代表的产物是_____,理由是__________;
(4)关于本反应体系中催化剂 的描述错误的是_____;
| A. |
射线衍射技术可测定 晶体结构 |
| B. |
可改变乙苯平衡转化率 |
| C. |
降低了乙苯脱氢反应的活化能 |
| D. |
改变 颗粒大小不影响反应速率 |
Ⅱ.苯乙烯的聚合
苯乙烯聚合有多种方法,其中一种方法的关键步骤是某 (Ⅰ)的配合物促进 (引发剂, 表示卤素)生成自由基 ,实现苯乙烯可控聚合。
(5)引发剂 中活性最高的是_____;
(6)室温下,① 在配体 的水溶液中形成 ,其反应平衡常数为 ;
② 在水中的溶度积常数为 。由此可知, 在配体 的水溶液中溶解反应的平衡常数为_____(所有方程式中计量系数关系均为最简整数比)。
金属 对 有强吸附作用,被广泛用于硝基或羰基等不饱和基团的催化氧化反应。将块状Ni转化成多孔型雷尼 后,其催化活性显著提高。
已知:①雷尼 暴露在空气中可以自燃,在制备和使用时,需用水或有机溶剂保持其表面“湿润”;
②邻硝基苯胺在极性有机溶剂中更有利于反应的进行。
某实验小组制备雷尼Ni并探究其催化氢化性能的实验如下:
步骤1:雷尼 的制备
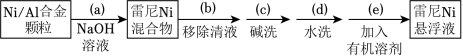
步骤2:邻硝基苯胺的催化氢化反应
反应的原理和实验装置图如图(夹持装置和搅拌装置略),装置Ⅰ用于储存 和监测反应过程。

回答下列问题:
(1)操作(a)中,反应的离子方程式是__________;
(2)操作(d)中,判断雷尼 被水洗净的方法是__________;
(3)操作(e)中,下列溶剂中最有利于步骤2中氢化反应的是_____;
| A. |
丙酮 |
| B. |
四氯化碳 |
| C. |
乙醇 |
| D. |
正己烷 |
(4)向集气管中充入 时,三通阀的孔路位置如图所示;发生氢化反应时,集气管向装置Ⅱ供气,此时孔路位置需调节为_____;

(5)仪器M的名称是:_____;
(6)反应前应向装置Ⅱ中通入 一段时间,目的是__________;
(7)如果将三颈瓶N中的导气管口插入液面以下,可能导致的后果是__________;
(8)判断氢化反应完全的现象是__________。
2﹣噻吩乙醇( )是抗血栓药物氯吡格雷的重要中间体,其制备方法如图:

Ⅰ.制钠砂。向烧瓶中加入 液体A和 金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至 ,加入 噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至 ,加入稍过量的环氧乙烷的四氢呋喃溶液,反应 。
Ⅳ.水解。恢复室温,加入 水,搅拌 ;加盐酸调 至 ,继续反应 ,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水 ,静置,过滤,对滤液进行蒸馏,蒸出四氢呋喃、噻吩和液体A后,得到产品 。
回答下列问题:
(1)步骤Ⅰ中液体A可以选择__________。
| A. |
乙醇 |
| B. |
水 |
| C. |
甲苯 |
| D. |
液氨 |
(2)噻吩沸点低于吡咯(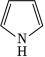 )的原因是__________。
)的原因是__________。
(3)步骤Ⅱ的化学方程式为__________。
(4)步骤Ⅲ中反应放热,为防止温度过高引发副反应,加入环氧乙烷溶液的方法是__________。
(5)步骤Ⅳ中用盐酸调节 的目的是__________。
(6)下列仪器在步骤Ⅴ中无需使用的是__________(填名称);无水 的作用为__________。

(7)产品的产率为__________(用 计算,精确至 )
钴配合物[Co(NH3)6]Cl3溶于热水,在冷水中微溶,可通过如下反应制备:2CoCl2+2NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+2H2O
2[Co(NH3)6]Cl3+2H2O
具体步骤如下:
Ⅰ.称取2.0gNH4Cl,用5mL水溶解。
Ⅱ.分批加入3.0gCoCl2•6H2O后,将溶液温度降至10℃以下,加入1g活性炭、7mL浓氨水,搅拌下逐滴加入10mL6%的双氧水。
Ⅲ.加热至55~60℃反应20min。冷却,过滤。
Ⅳ.将滤得的固体转入含有少量盐酸的25mL沸水中,趁热过滤。
Ⅴ.滤液转入烧杯,加入4mL浓盐酸,冷却、过滤、干燥,得到橙黄色晶体。
回答下列问题:
(1)步骤Ⅰ中使用的部分仪器如图。

仪器a的名称是 。加快NH4Cl溶解的操作有 。
(2)步骤Ⅱ中,将温度降至10℃以下以避免 、 ;可选用 降低溶液温度。
(3)指出下列过滤操作中不规范之处: 。

(4)步骤Ⅳ中,趁热过滤,除掉的不溶物主要为 。
(5)步骤Ⅴ中加入浓盐酸的目的是 。
某小组开展“木耳中铁元素的检测”活动。检测方案的主要步骤有:粉碎、称量、灰化、氧化、稀释、过滤、滴定等。回答问题:
(1)实验方案中出现的图标 和
和 ,前者提示实验中会用到温度较高的设备,后者要求实验者_____(填防护措施)。
,前者提示实验中会用到温度较高的设备,后者要求实验者_____(填防护措施)。
(2)灰化:干燥样品应装入_____中(填标号),置高温炉内,控制炉温 ,在充足空气氛中燃烧成灰渣。
| A. |
不锈钢培养皿 |
| B. |
玻璃烧杯 |
| C. |
石英坩埚 |
(3)向灰渣中滴加 的硝酸,直至没有气泡产生。灰化容器中出现的红棕色气体主要成分是_____(填化学式),因而本实验应在实验室的_____中进行(填设施名称)。
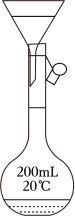
若将漏斗直接置于容量瓶上过滤收集滤液(如图所示),存在安全风险,原因是__________。
(4)测定铁含量基本流程:将滤液在 容量瓶中定容,移取 ,驱尽 并将 全部还原为 。用 微量滴定管盛装 标准溶液进行滴定。
①选用微量滴定管的原因是__________。
②三次平行测定的数据如表。针对该滴定数据,应采取的措施是_____。
|
序号 |
1 |
2 |
3 |
|
标准溶液用量/ |
|
|
|
③本实验中,使测定结果偏小的是_____(填标号)。
| A. |
样品未完全干燥 |
| B. |
微量滴定管未用标准溶液润洗 |
| C. |
灰渣中有少量炭黑 |
磷酸二氢钾在工农业生产及国防工业等领域都有广泛的应用。某研究小组用质量分数为 的磷酸与 反应制备 ,反应方程式为 一定条件下的实验结果如图1所示。

回答问题:
(1)该条件下,反应至 时 的转化率为_____。
(2)该制备反应的ΔH随温度变化关系如图2所示。该条件下反应为_____反应(填“吸热”或“放热”),且反应热随温度升高而_____。
(3)该小组为提高转化率采用的措施中有:使用浓磷酸作反应物、向系统中不断通入水蒸气等。它们能提高转化率的原因是:不使用稀磷酸__________;通入水蒸气__________。
(4) 时, 的平衡常数 _____。(已知 的 )
水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与 碱性悬浊液(含有 )混合,反应生成 ,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化, 被 还原为 ,在暗处静置 ,然后用标准 溶液滴定生成的 ( )。
回答下列问题:
(1)取水样时应尽量避免扰动水体表面,这样操作的主要目的是_____________。
(2)"氧的固定"中发生反应的化学方程式为_______________。
(3) 溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____及二氧化碳。
(4)取 水样经固氧、酸化后,用 溶液滴定,以淀粉溶液作指示剂,终点现象为________________;若消耗 溶液的体积为 ,则水样中溶解氧的含量为_________mg·L − 1。
(5)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________。(填"高"或"低")
丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷( )脱氢制1-丁烯( )的热化学方程式如下:
① Δ H 1
已知:②
③
反应①的Δ H 1为________kJ·mol −1。图(a)是反应①平衡转化率与反应温度及压强的关系图, x_________0.1(填"大于"或"小于");欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
| A. |
升高温度 |
B. |
降低温度 |
C. |
增大压强 |
D. |
降低压强 |
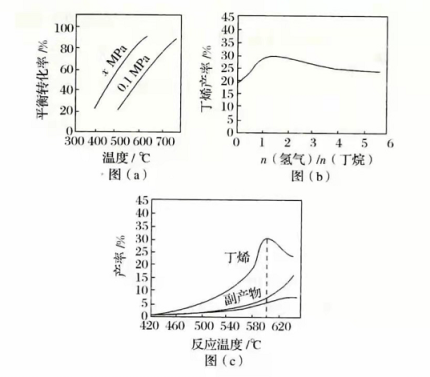
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中 n(氢气)/ n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
水泥是重要的建筑材料。水泥熟料的主要成分为 、 ,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
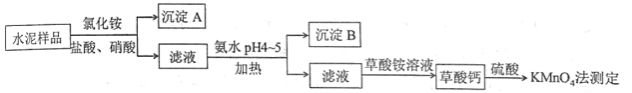
回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__________,还可使用___________代替硝酸。
(2)沉淀A的主要成分是_________________,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____________________________________。
(3)加氨水过程中加热的目的是___________。沉淀B的主要成分为_____________、____________(写化学式)。
(4)草酸钙沉淀经稀 处理后,用 标准溶液滴定,通过测定草酸的量可间接获知钙的含 量,滴定反应为: 。实验中称取 水泥样品,滴定时消耗了 的 溶液 ,则该水泥样品中钙的质量分数为______________。
重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 ,还含有硅、铝等杂质。制备流程如图所示:

回答下列问题:
(1)步骤①的主要反应为:
上述反应配平后 与 的系数比为________。该步骤不能使用陶瓷容器,原因是________。
(2)滤渣1中含量最多的金属元素是________,滤渣2的主要成分是________及含硅杂质。
(3)步骤④调滤液2的 使之变________(填"大"或"小"),原因是________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向"滤液3"中加入适量 ,蒸发浓缩,冷却结晶,过滤得到 固体。冷却到________(填标号)得到的 固体产品最多。
a.
b.
c.
d.
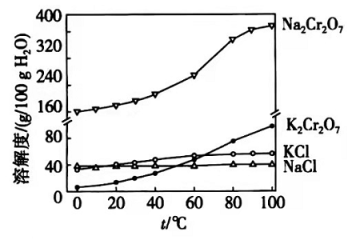
步骤⑤的反应类型是________。
(5)某工厂用 铬铁矿粉(含 40%)制备 ,最终得到产品 ,产率为________。
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:________、________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和 )(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
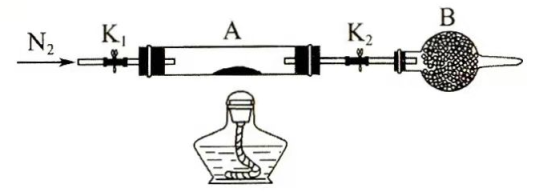
①仪器B的名称是________。
②将下列实验操作步骤正确排序________(填标号);重复上述操作步骤,直至A恒重,记为 。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭 和
d.打开 和 ,缓缓通入
e.称量Af.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目 ________(列式表示)。若实验时按a、d次序操作,则使x________(填"偏大""偏小"或"无影响")。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开 和 ,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
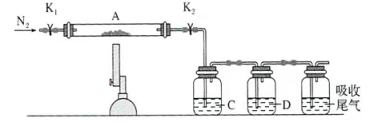
① 中的溶液依次为________(填标号)。 中有气泡冒出,并可观察到的现象分别为________。
a.品红
b.
c.
d.
e.浓
②写出硫酸亚铁高温分解反应的化学方程式________。
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为: 。下图为刚性容器中,进料浓度比 c(HCl) ∶ 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
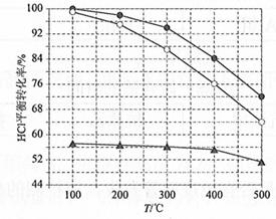
可知反应平衡常数 K(300℃)________ K(400℃)(填"大于"或"小于")。设HCl初始浓度为 , 根据进料浓度比 c(HCl)∶ c(O 2)=1∶1的数据计算 K(400℃)=________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 c(HCl)∶ 过低、过高的不利影响分别是________。
(2)Deacon直接氧化法可按下列催化过程进行:
Δ
Δ
Δ
则 的 Δ H=________ 。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
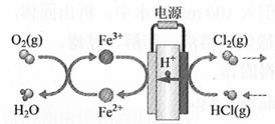
负极区发生的反应有________(写反应方程式)。电路中转移1 mol电子,需消耗氧气________L(标准状况)
试题篮
()