根据下图所示的A、B、C、D、E 五种物质的相互转化关系,按如下关系填写相应的物质和有关反应的化学方程式: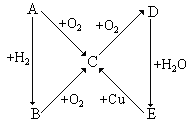
(1)当A是气体单质时,B是_________,C是____________,E是______________,由D 生成E的反应的化学方程式是__________________。
(2)当A是固体单质时,A是_________,B是____________,D是______________,由E 生成C的反应的化学方程式是__________________。
大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验。
(1)写出实验室制取氨气的化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 作干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 ,该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法。
水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2,还含有CO2和水蒸气,请用下图所示装置设计一个实验,以确认上述混合气中含有CO和H2。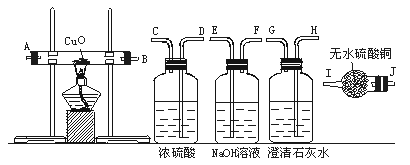
(1)连接上述装置的正确顺序是:(填接口字母)混合气→( ),( )接( ),( )接( ),( )接( ),( )接( ),( ).
(2)确认混合气中含有H2的实验现象是__________,其理由是_________________。
强热条件下,硫酸亚铁固体发生分解:2FeSO4=Fe2O3+SO2↑+SO3↑,如将此反应生成的气体通入BaCl2溶液中,则( )
| A.析出BaSO3沉淀 | B.析出BaSO4沉淀 |
| C.逸出SO3气体 | D.逸出SO2气体 |
将4.68gNaNO3、NaCl、Na2CO3的混合物溶于水,向其中滴加30mL1.00mol/LAgNO3溶液后,不再有沉淀生成。过滤后,使沉淀与足量稀硝酸作用,产生112mL(标准状况)气体。计算原混合物中NaCl的质量分数。
如图所示,在火棉胶袋(半透膜)内注入淀粉和食盐溶液,用线系紧密封,使细玻管内的液面刚好高出烧杯内蒸馏水的液面,过一段时间后用碘酒和硝酸银溶液分别检验蒸馏水。整个实验过程中,所观察到的现象是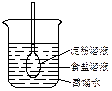
| A.细玻管内液面上升 | B.细玻管内液面不变 |
| C.蒸馏水遇碘酒变蓝 | D.蒸馏水遇硝酸银溶液有白色沉淀生成 |
将淀粉碘化钾混合溶液装在羊皮纸制成的袋中,将此袋下半部浸泡在盛有蒸馏水的烧杯里,过一段时间后取烧杯中液体进行实验,下列现象能证明羊皮袋一定有破损的是
| A.加入碘水变蓝色 |
| B.加入NaI溶液不变蓝色 |
| C.加入AgNO3溶液产生黄色沉淀 |
| D.加入溴水变蓝色 |
下列说法正确的是( )
| A.第ⅥIA族元素从上到下,其氢化物的还原性依次减弱 |
| B.同周期从左到右,非金属元素最高价氧化物对应的水化物的酸性依次增强 |
| C.第三周期元素的离子半径从左到右逐渐减小 |
| D.CCl4属于共价化合物,每个原子都满足8电子结构,其水溶液能导电 |
一定条件下,RO和氟气可发生如下反应:RO+F2+2OH-===RO+2F-+H2O从而可知在RO中,元素R的化合价是
| A.+4 | B.+5 | C.+6 | D.+7 |
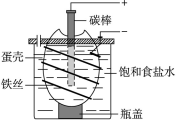
电解饱和食盐水简易装置
38.4 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到气体22.4 L(标准状况下,不考虑N2O4),则反应消耗的硝酸的物质的量是
| A.1.0 mol |
| B.1.6 mol |
| C.2.2 mol |
| D.2.4 mol |
有Na2CO3、AgNO3、BaCl2、HCl及NH4NO3的无标签溶液,为鉴别它们,取四支试管分别装入一种溶液,向上述四支试管中加入少许剩下的一种溶液,下列结论错误的是
| A.有三支试管出现沉淀时,则后加入的是AgNO3溶液 |
| B.全部若没有什么现象变化时,则后加的是NH4NO3溶液 |
| C.一支试管出现气体,两支试管出现沉淀时,最后加入的是HCl溶液 |
| D.若只有两支试管出现沉淀时,则最后加入的是BaCl2溶液 |
现有两瓶溶液,新制饱和氯水和亚硫酸,下列方法或试剂(必要时可加热)能用于鉴别它们的是
①观察颜色 ②石蕊试剂 ③品红溶液
| A.只有①② |
| B.只有①③ |
| C.只有②③ |
| D.①②③ |
下列过程最终无沉淀产生的是
| A.过量氨气通入Al2(SO4)3溶液 |
| B.CO2通入CaCl2溶液 |
| C.少量SO2通入BaCl2溶液后再通入过量Cl2 |
| D.过量CO2通入Na2SiO3溶液 |
(12分)在右图所示的实验装置中,A中盛有品红溶液,B中盛有NaOH溶液。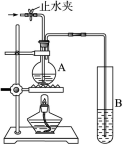 请回答下列问题:
请回答下列问题:
(1)若向A中通入足量的二氧化硫气体,A中的现象是______________________。
(2)若向A中通入足量的氯气后,再加热A,A中的溶液______(填“能”或“不能”)恢复到原来的颜色。
(3)如果A中盛的是氨水,B中盛的是无色酚酞溶液,微热A,B中溶液会变为红色,则此时表现氨水具有______性和______性。
(4)如果A中盛的是浓硫酸,加入铜,加热反应,此反应中表现浓硫酸的酸性和______性。
(5)如果A中盛的是盐酸,加入铜粉,为了让铜粉溶解,可以加入NaNO3,反应的离子方程式为:3Cu+2NO+8H+===3Cu2++2NO↑+4H2O,请用单线桥标出其电子转移的方向和数目。
(9分)下图所涉及的物质均为中学化学中的常见物质, 其中C为O2、D为Cl2、E为Fe单质,其余为化合物。它们存在如图转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的化学式:
F______,G______,H______。
(2)指出MnO2在相关反应中的作用,反应①中是______剂,反应②中是______。
(3)若反应①是在加热条件下进行,则A是______;若反应①是在常温条件下进行,则A是______。
(4)写出B与MnO2共热获得D的离子方程式________________________________。
(5)写出B与F反应的化学方程式_______________________________________。
试题篮
()