草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:

回答下列问题:
(1)和
在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为、。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是,滤渣是;过滤操作②的滤液是和滤渣是。
(3)工艺过程中③和④的目的是。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250g溶于水中,用0.0500 的酸性
溶液滴定,至粉红色不消褪,消耗
溶液15.00
,反应的离子方程式为;列式计算该成品的纯度。
明矾石经处理后得到明矾【】。从明矾制备
、
和
的工艺过程如下所示:

焙烧明矾的化学方程式为:
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是。
(2)从水浸后的滤液中得到晶体的方法是。

(3)在一定条件下可制得
,其晶体结构如右图所示,该晶体中
的配位数是。
(4)以和
为电极,
溶液为电解液组成一种新型电池,放电时
转化为
,该电池反应的化学方程式是。
(5)焙烧产生的可用于制硫酸。已知25℃、101
时:
;
;
。
则与
反应的热化学方程式是。
焙烧948明矾(
),若
的利用率为96%,可生产质量分数为98%的硫酸
。
废旧硬质合金刀具中含碳化钨()、金属钴(
)及少量杂质铁,利用电解法可回收
和
。工艺流程简图如下:

(1)电解时废旧刀具做阳极,不锈钢做阴极,溶液为电解液。阴极主要的电极反应式为。
(2)净化步骤所得滤饼的主要成分是。回收的洗涤液代替水配制电解液,目的是回收利用其中的。
(3)溶液I的主要成分是。洗涤不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是。
(4)将还原成
粉的化学反应方程式为。
化学与生产、生活、社会密切相关,下列说法正确的是
| A.氯气可用于漂白,是因为氯气有强氧化性 |
| B.工业用石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱有关 |
| C.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料。 |
| D.硫酸工业中,从吸收塔上部导出的气体再次通入接触室进行二次氧化,进一步吸收后,二氧化硫的含量很少,可直接排放到空气中 |
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)过量的SO2与NaOH溶液反应的离子方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的
尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗食盐水(含Ca2+、Mg2+、SO2-4等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下: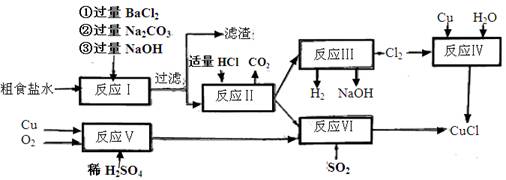
(1)反应I中加Na2CO3溶液的作用是 。
(2)反应II在电解条件下进行,电解时阳极发生的电极反应可表示为 。
(3)①写出反应V的化学方程式
②写出反应VI的离子反应方程式 。
(4)在整个合成过程中可以循环利用的物质是
(5)反应IV加入的Cu必须过量,其目的是 。
(6)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 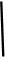 。
。
大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程:
请回答下列问题:
(1)试剂A的名称是 ;
(2)操作I的目的是 ;
(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有 ;
(4)写出反应②中生成CaO2·8H2O的化学方程式: ;
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
(1)在一定条件下,SO2转化为SO3的反应为2SO2(g)+O2(g) 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为
该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
(1)A的化学式为 。
(2)写出反应V的化学方程式 。
(3)写出反应VI的离子方程式为 。
(4)本工艺中可以循环利用的物质是(用化学式表示) 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 、 。
工业上可用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制取干电池中所需的MnO2和Zn,其工艺流程如下: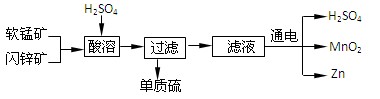
下列说法正确的是
| A.酸溶时,MnO2作还原剂 | B.可用盐酸代替硫酸进行酸溶 |
| C.原料硫酸可以循环使用 | D.在电解池的阴极处产生MnO2 |
[化学—选修化学与技术]
Ⅰ.请选出下列各题中符合题意的选项:
(1)下列污水处理方法只涉及物理变化的是
A.过滤法 B.氧化还原法 C.中和法 D.化学沉淀法
(2)目前下列工艺过程没有直接使用离子交换技术的是
A.硬水的软化 B.电解饱和食盐水制造NaOH
C.电渗析淡化海水 D.海水中提取金属Mg
(3)根据课本的介绍,下列工业生产过程中不需要使用氨水或氨气的是
A.硫酸的工业制法 B.石油的催化裂化
C.硝酸的工业制法 D.侯氏制碱法
Ⅱ.水处理技术在生产、生活中应用广泛。
(1)含有较多 离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为 (写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过 (填“RH”或“ROH”)型离子交换树脂,原因是 。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为 。电渗析法净化水时,使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的 。
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备 CuSO4·5H2O及纳米材料G,主要步骤如下:
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2 +生成沉淀的pH 分别如下:
| 物质 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe(OH)3 |
2.2 |
3.2 |
| Fe(OH)2 |
7.6 |
9.6 |
| Cu(OH)2 |
4.7 |
6.4 |
请回答下列问题:
(1)在相同温度时溶度积的相对大小:Ksp[Fe(OH)2]______(填“>”或“<”)Ksp[Cu(OH)2]。
(2)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。试剂①是一种氧化剂,目的是氧化_____________(填离子符号)。该工厂选用试剂①最好为下列中的 (填代号)。
a. Na2O2 b. H2O2 c. Cl2 d. KSCN
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是溶液温度控制在_______℃,pH控制在________,氧化时间为________小时左右。
(4)向溶液B中加入试剂②的化学式为_______,操作Ⅰ的名称是_________。
(5)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4-被还原为Mn2+,则该反应的离子方程式为_____________________________________________。取A溶液20.00 mL,用去0.0240 mol/L KMnO4溶液16.00 mL时恰好达到滴定终点,则A溶液中Fe2+浓度为 。
化工生产需要用到各种原料,其中与事实相符合的是
| A.用乙醇和浓硫酸制乙烯 | B.用电解水获得的氢气来合成氨 |
| C.用晒盐后的卤水制溴单质 | D.用氢氧化钠和二氧化碳制碳酸钠 |
.硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见图3)。下列说法正确的是
图3
| A.CO、SO2、SO3均是酸性氧化物 |
| B.工业上利用Cl2和澄清石灰水反应来制取漂白粉 |
| C.除去与水反应,图3所示转化反应均为氧化还原反应 |
| D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是 ;
(2)检验“水洗”是否合格的方法是 ;
(3)沉淀时常用冰水控制温度在0℃左右,其可能原因是(写出两种):
① ;② 。
(4)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-= 2I-+S4O62-】
①CaO2的质量分数为 (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是_______________。
试题篮
()