制取普通玻璃的主要原料是
①Na2SiO3 ②CaCO3 ③CaSiO3 ④SiO2 ⑤Na2CO3 ⑥CaO
| A.①③④ | B.②④⑥ | C.②④⑤ | D.③④⑤ |
化学是在原子、分子水平上研究物质的组成、结构、性质、变化、制备和应用的自然科学。下列不属于化学研究发展方向或说法不正确的是 ( )
| A.高铁酸钾广泛用于废水的净化处理,因为它具有强还原性 |
B.最近合成117号元素的反应为: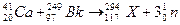 ,该变化不属于化学变化 ,该变化不属于化学变化 |
| C.“原子经济”和“零排放”是绿色化学和化工的发展目标 |
D.最近在星际介质中发现的分子薏(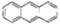 ),该分子中所有原子可以处于同一平面 ),该分子中所有原子可以处于同一平面 |
重铬酸钠(Na2Cr2O7)广泛用于合成颜料、媒染剂等,以铬铁矿(主要成分为Cr2O3,还有FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程图如下: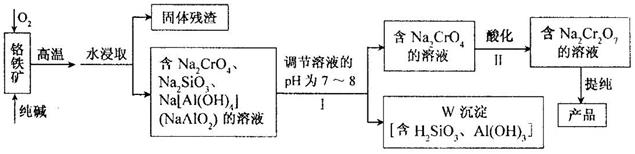
请回答下列问题。
⑴铬铁矿中的Cr2O3与纯碱、O2在高温下反应的化学方程式为 ▲ 。
⑵若Ⅰ中只用一种试剂调节溶液的pH,应选用 ▲ (填标号)。
A.稀硫酸 B.氧化钠固体 C.氢氧化钾溶液
⑶Ⅰ中,调节溶液pH后,如果溶液的pH过小,可能导致W沉淀部分溶解,原因是:
▲ 。(用离子方程式表示)。
⑷Ⅱ中,Na2CrO4转化为Na2Cr2O7的离子反应如下:
2CrO42-(黄色)+2H+ Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O
①该反应 ▲ (填“是”或“不是”)氧化还原反应。
②若往Na2Cr2O7溶液(橙红色)中加入足量NaOH固体,溶液 ▲ (填标号)。
A.变黄色 B.颜色不变 C.橙红色变深
③已知:25℃,Ag2CrO4的Ksp=1.12×10-12,Ag2Cr2O7的Ksp=2×10-7。25℃,往Na2Cr2O7溶液中加入AgNO3溶液,最终只生成一种砖红色沉淀,该沉淀的化学式是 ▲ 。
“纳米材料”是当今材料科学研究的前沿,1纳米(nm)=10-9m,其研究成果广泛应用于催化及军事科学中。“纳米材料”是指研究、开发出的直径从几纳米至几十纳米的材料。如将“纳米材料”分散到蒸馏水中,所得混合物可能具有的性质是( )
| A.能全部透过半透膜 | B.有丁达尔效应 |
| C.不能透过滤纸 | D.所得分散系一定是浊液 |
“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀
| A.①④⑤ | B.②③④ | C.②③⑤ | D.①③④⑥ |
纳米材料是由纳米粒子(粒子直径 1 nm ~100nm)所组成的材料,它具有奇特的光、热、声、电、磁、力学和化学活泼性等理化性质.下列分散系中不含纳米粒子的是( )
| A.无尘无雾含水蒸气的空气 | B.豆浆 |
| C.血液 | D.有色玻璃 |
I 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤: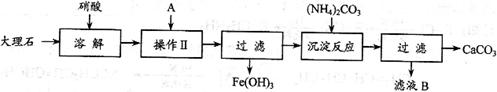
(1)用硝酸溶解大理石时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
、 。
(2)操作Ⅱ的目的是  , 若A为溶液,则A可以是 。
, 若A为溶液,则A可以是 。
(3)写出加入碳酸铵所发生反应的离子方程式:  。
。
II 以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: 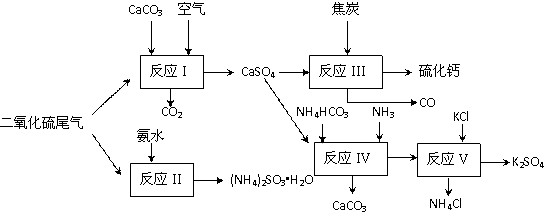
(4)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
(5)下列有关说法正确的是 。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C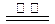 CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
(6)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是 。
(7) (NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 。
硅酸铜钡是当今用最新科学技术才能合成的一种物质,然而现在发现我国秦朝兵马俑用的一种颜料竟是硅酸铜钡。下列关于硅酸铜钡的说法不正确的是
| A.难溶于水 | B.易溶于水 | C.属于硅酸盐 | D.属于复盐 |
下列说法不正确的是 ( )
| A.我国以三个强度等级(42.5、52.5、62.5)表示水泥的性能,等级越高性能越好 |
| B.在玻璃中加入金属氧化物,可以使玻璃呈现颜色,例如加入氧化亚铜(Cu2O)呈蓝色 |
| C.新型陶瓷分成两大类,即结构陶瓷(如纳米陶瓷)和功能陶瓷(如生物陶瓷) |
| D.光导纤维的主要成分是石英玻璃 |
下列关于物质用途的叙述中不正确的是
| A.工业上利用蛋白质的水解反应生产肥皂和甘油 |
| B.从石油中获得乙烯是工业生产乙烯的主要途径 |
| C.通过海水可以制取氯化钠、镁、烧碱等物质 |
| D.晶体硅是良好的半导体材料,可制成光电池等 |
钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。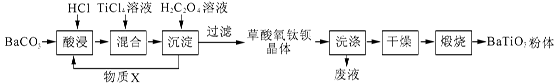
(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ;
可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
医用氯化钙 可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为: 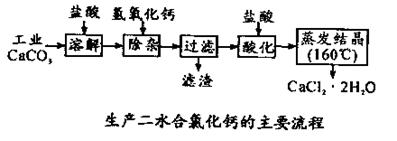
(1)CaCO3与盐酸反应的离子方程式 。
(2)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。滤渣主要成分的化学式 。
(3)酸化时加盐酸的目的为:
① ,
②防止Ca2+ 在蒸发时发生水解。
(4)为什么蒸发 结晶要保持在160℃: 。
结晶要保持在160℃: 。
(5)为测定样品中CaCl2 ·2H2O的含量,称取0.7522g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.04mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL。
①通过计算,样品中含CaCl2 ·2H2O的质量分数 。
②若所测样品 CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
。
(16分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,该水解反应的化学方程式为 。再经过滤、水洗除去其中的Cl–,再烘干、焙烧除去水分得到粉体TiO2。检验TiO2·xH2O中Cl–是否被除净的方法是 。
(2)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是 ;
②滴定终点的现象是 。
③滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为 。
④下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果 。
若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果 。
试题篮
()