X、Y、Z、R、T、U分别代表原子序数依次增大的短周期主族元素。X元素原子的质子数等于其电子层数;Y的基态原子核外电子有5种不同的运动状态;Z与T同主族且原子序数T是Z的两倍;R元素的原子半径在短周期主族元素中最大。请回答下列问题:
(1)Z的基态原子电子排布式为_______;TZ32-离子的空间构型为_______。
(2)T、U的最高价氧化物对应的水化物酸性由强到弱的顺序为__________(填化学式)。
(3)化合物RU的晶体类型为 ;已知RU晶胞体积为Vcm3,RU的摩尔质量为M g/mol则该晶体密度p= (用含V、M的式子表示)。
(4)将Y2X6气体通人H20中反应生成一种酸和一种单质,该反应的化学方程式是 。(已知:Y的电负性为2.0,X的电负性为2.1)
A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、
C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
| 化合物 |
甲 |
乙 |
丙 |
丁 |
| 组成元素 |
B、C |
A、C |
A、D |
C、D |
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)丙物质的化学式为 ,丁物质中阴离子与阳离子的个数之比为 。
(2)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为 。
(3)某同学设计了一个以结构简式为 BA3-CA的物质为燃料的电池,并用该电池电解200mL一定浓度的NaCl与CuSO4的混合溶液,其装置如下图:

①写出ⅰ中通入该物质这一极的电极反应式 。

②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;原混合液中CuSO4溶液物质的量浓度为 mol/L。
A、B、D、E、G 是原子序数依次增大的五种短周期元素。A 与E 同主族,A、B 和E的原子最外层电子数之和为19,B 与G 的单质都能与H2 反应生成“HX”(X 代表B 或G)型氢化物,D 为同周期主族元素中原子半径最大的元素。
(1) B 在元素周期表中的位置是_____________。
(2) D 的两种常见氧化物中均含有____________(填“离子键”或“共价键”)
(3) E 的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为_______。
(4) D 的最高价氧化物对应水化物的溶液与G 的单质反应,反应的离子方程式为_______。
(5) 共价键的极性随共用电子对偏移程度的增大而增强,A 和E 所形成氢化物中,共价键
极性的强弱顺序为____________>___________(用化学式表示)。
(6) 用原子结构解释“B、G 单质都能与H2 反应生成HX 型氢化物”的原因:_________。
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,
则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。
该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表
示生成1mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1
c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
[化学——物质结构与性质]尿素 可用于制有机铁肥,主要代表有
可用于制有机铁肥,主要代表有 [三硝酸六尿素合铁(III)]。
[三硝酸六尿素合铁(III)]。
(1)基态Fe3+的核外电子排布式为__________。C、N、O三种元素的第一电离能由大到小的顺序是__________。
(2)尿素分子中C、N原子的杂化方式分别是___________。
(3)  中“
中“ ”与Fe(III)之间的作用力是___________。与
”与Fe(III)之间的作用力是___________。与 互为等电子体的一种化合物是___________(写化学式)。
互为等电子体的一种化合物是___________(写化学式)。
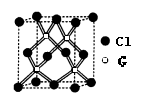
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有__________个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比是___________。
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,且原子最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是



A.在地壳中,C元素的含量位于第一位
B.C元素位于元素周期表中的第3周期第ⅠA族
C.A、B、D三种元素形成的化合物一定是强酸
D.B元素与氢元素形成化合物的化学式一定为H2B
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域.一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)Cu+基态的电子排布式可表示为____________。
(2)1mol甲醛(HCHO)中含有的σ键数目为______________。
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为______________。这两种不同化合物的化学式分别为________________、_______________。
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应生成铜氨离子Cu(NH3)42+,①反应的离子方程式为_________;②[Cu(NH3)4]2+中存在的化学键类型有_______(填序号)。
| A.配位键 | B.离子键 | C.极性共价键 | D.非极性共价键 |
(5)金属铍与氯气也可以形成化合物,在气态二氯化铍中有单体BeCl2和二聚体(BeCl2)2;在晶体中变形成多聚体(BeCl2)n。试画出各种存在形式的结构式,并指出对应Be原子的杂化轨道类型。
结构式_________杂化轨道类型________
结构式_________杂化轨道类型________
结构式_________杂化轨道类型________
A、B、C、D、E、F 6种元素,它们的核电荷数依次增大,且都小于36。其中C、E、F是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示) 。
(2)元素B与D的电负性的大小关系是 ,C与E的第一电离能的大小关系是 。(填>、<、=,用元素符号表示)
(3)用轨道表示式表示D元素原子的价电子构型 。
(4)C、E最高价氧化物对应的水化物相互反应的离子方程式为 。
(5)F在元素周期表中的位置是 区,其基态原子的电子排布式为 。
(6)均为A、B、D、E四种元素组成的两种化合物可以相互反应,写出该反应的离子方程式为 。
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素。下列说法正确的是( )
A.1 mol 由元素A、B组成的化合物一定含有18 mol e-
B.元素C、D的最高价氧化物对应的水化物之间不可能发生反应
C.含D的盐溶液既可能显酸性,也可能显碱性
D.化合物AE与CE含有相同类型的化学键
【化学选修3—物质结构与性质】A、B、C、D、E、F、G为原子序数依次增大的前四周期元素。A、F原子的最外层电子数均等于其周期序数.F原子的电子层数是A的3倍; B原子核外电子分处3个不同能级。且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对.E与F同周期;G的原子序数等于A、C、D、F 四种元素原子序数之和。
(1)写出B的基态原子的核外电子排布图 ;回答E与F原子的第一电离能的大小关系怎样,原因是 ;
(2)C3-是一种弱酸根离子,请写出两种与C3-互为等电子体的分子的化学式 , ;
(3)A与D形成的A2D2分子中D原子的杂化类型为 杂化,A与C形成的最简单分子易溶于水的原因 ;
(4)G的晶体中原子按 (填“ABABAB”或“ABCABCABC”)的方式堆积而成,G的晶体堆积模型名称 ;
(5)G的晶体中G原子的配位数为 ,空间利用率为 ;
(6)元素G的一种氯化物的晶胞如图所示,该氯化物的化学式 ,两种微粒间最短距离为460.0 pm,晶体密度为 g/cm3。(列式表示)
X、Y、Z、J、Q五种短周期主族元素,原子序数依次增大,元素Z在地壳中含量最高,J元素的焰色反应呈黄色,Q的最外层电子数与其电子总数比为3:8,X能与J形成离子化合物,且J+的半径大于X—的半径,Y2是空气主要成分之一。请回答:
(1)Q元素在周期表中的位置_______________________;
(2)这五种元素原子半径从大到小的顺序为_______________________(填元素符号)
(3)元素的非金属性Z_________Q(填“>”或“<”),下列各项中,不能说明这一结论的事实有___________(填序号)
A.Q的氢化物的水溶液放置在空气中会变浑浊
B.Z与Q之间形成的化合物中元素的化合价
C.Z和Q的单质的状态
D.Z和Q在周期表中的位置
(4)Q的氢化物与它的低价氧化物反应的化学方程式为_____________________
(5)X与Y可形成分子A,也可形成阳离子B,A、B在水溶液中酸、碱性恰好相反,写出A的电子式____________;实验室制备气体A的化学方程式 B的水溶液不呈中性的原因___________________(用离子方程式表示)
(6)若使A按下列途径完全转化为F:

①F的化学式为_____________;
②C→F过程中氧化剂与还原剂的物质的量之比为_____________。
A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8。请回答:
(1)试写出B2单质的电子式为           。试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式               。
(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式是                           。
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色单质,且产物对大气无污染,其化学反应方程式是                             。
(4)在2 L的密闭容器中,通入2 mol B2气体和3 mol A2气体,一定温度下反应生成BA3气体,当反应达到平衡时,A2的浓度为0.15 mol·L-1,同时放出约83.2 kJ的热量,该反应的热化学方程式为                                                       。
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式              ;若0.1 mol该化合物完全反应,转移电子的物质的量为             。
CaC2可用于固氮:CaC2+N2 CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
CaCN2+C,CaCN2(氰氨化钙)和水反应可生成NH3。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。
(2)C、N、O三种元素的第一电离能由小到大的顺序是 。
(3)NH3中N原子的杂化方式为 ;根据价层电子对互斥理论推测CO32-的空间构型为 。
(4)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式
A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,A的原子核内无中子,B、F在元素周期表中的相对位置如图,B与氧元素能形成两种无色气体,D是地壳中含量最多的元素,E是地壳中含量最多的金属元素。
| B |
|
|
| |
|
F |
(1)BF2的结构式为____________。
(2)D和F的氢化物中沸点较高的是_________(填化学式)。
(3)实验室制取G2气体的离子方程式为______________。
(4)在微电子工业中,C的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为____________________。
(5)FD2气体通入BaCl2和C的最高价氧化物对应的水化物的混合溶液中,生成白色沉淀和无色气体,有关反应的离子方程式为___________________________________________________。
(6)火箭使用B2A8C2作燃料,N2O4为氧化剂,燃烧放出的巨大能量能把火箭送入太空,并且产生三种无污染的气体,其化学方程式为_______________________.
(7)上述元素可组成盐Q:CA4E(FD4)2。向盛有20mL0.5mol/LQ溶液的烧杯中加入12mL2.0mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为_________。
试题篮
()