Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用,回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________。(填标号)
| A. | |
| B. | |
| C. | |
| D. | |
(2) 与 具有相同的电子构型, 小于 ,原因是________。
(3) 是有机合成中常用的还原剂, 中的阴离子空间构型是________。中心原子的杂化形式为________, 中,存在________(填标号)。
| A. | 离子键 |
| B. | σ键 |
| C. | π键 |
| D. | 氢键 |
(4) 是离子晶体,其晶格能可通过图(a)的 Born-Haber循环计算得到

可知,Li原子的第一电离能为________ , O=O键键能为________ , 晶格能为________
(5) 具有反莹石结构,晶胞如图(b)所示。已知晶胞参数为0.4665mm,阿伏加德罗常数的值为 ,则 的密度为 ________ (列出计算式)。
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用.回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为nm(填标号).
| A. | 404.4 |
| B. | 553.5 |
| C. | 589.2 |
| D. | 670.8 |
| E. | 766.5 |
(2)基态K原子中,核外电子占据的最高能层的符号是________,占据该能层电子的电子云轮廓图形状为________.K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是________.
(3)X射线衍射测定等发现, 中存在 离子. 离子的几何构型为________,中心原子的杂化类型为________.
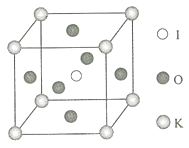
(4) 晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为 ,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示.K与O间的最短距离为________nm,与K紧邻的O个数为________.
(5)在KIO 3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O处于________位置.
Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)基态Fe 2+与Fe 3+离子中未成对的电子数之比为 。
(2)Li及其周期表中相邻元素的第一电离能(I 1)如表所示。I 1(Li)>I 1(Na),原因是 。 I 1(Be)>I 1(B)>I 1(Li),原因是 。
| I 1/(kJ•mol ﹣ 1) |
||
| Li 520 |
Be 900 |
B 801 |
| Na 496 |
Mg 738 |
Al 578 |
(3)磷酸根离子的空间构型为 ,其中P的价层电子对数为 、杂化轨道类型为 。
(4)LiFePO 4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO 4的单元数有 个。
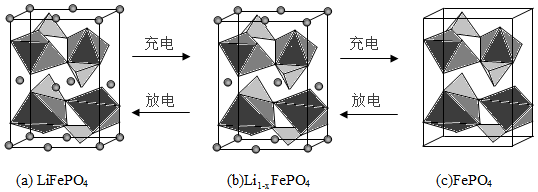
电池充电时,LiFePO 4脱出部分Li +,形成Li 1 ﹣ xFePO 4,结构示意图如(b)所示,则x= ,n(Fe 2+):n(Fe 3+)= 。
试题篮
()