甲醇(CH3OH)广泛用于作燃料电池的燃料,可用天然气来合成。已知
下列说法不能得出的结论是:
| A.反应不需要加热就能进行 |
B. , , |
C.甲醇的燃烧热为: |
D.若CO的燃烧热 ,则氢气的燃烧热 ,则氢气的燃烧热 |
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是 ( )
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
.以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,电池反应为:
有关下列说法错误的是( )
| A.氨燃料电池在放电时,氨气被氧化 |
| B.氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH- |
| C.以氨气代替氢气的主要原因是:氨气易液化易储存 |
| D.燃料电池的能量转化率一般比普通的电池高 |
下列说法正确的是
| A.氢氧燃料电池的能量转换形式之一为化学能转化为电能 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
| D.催化剂通过降低化学反应的焓变加快化学反应速率 |
下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是 
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-="=" 2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置。 |
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为________;
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________;
(3)已知H2O(l)=H2O(g) ΔH3=+44 kJ·mol-1,则表示肼燃烧热的热化学方程式为________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________。
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用上图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。下列正确的是:( )
| A.由TiO2制得1mol 金属Ti ,理论上外电路转移2NA电子 |
| B.阳极的电极反应式为:C + 2O2- - 4e- ="=" CO2↑ |
| C.若用铅蓄电池作该装置的供电电源,“ +”接线柱应连接Pb电极 |
| D.在制备金属钛前后,整套装置中CaO的总量减少 |
下列有关电化学原理的说法中,错误的是
| A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 |
| B.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
| C.氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 |
| D.可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
下列叙述不正确的是
| A.太阳能蓄电池只是将太阳能直接转化为电能的装置 |
| B.燃料电池是将化学能直接转化为电能的装置,所以能量利用率高 |
| C.碱性Zn-Mn干电池比酸性Zn-Mn干电池耐用,且不易漏液 |
| D.手机上用的锂离子电池属于二次电池 |
铅蓄电池的电池反应为 Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法错误的是
2PbSO4(s)+2H2O(l),下列说法错误的是
| A.放电时电解质溶液的H+浓度逐渐减小 |
| B.利用铅蓄电池电解饱和食盐水制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少0.10 mol |
| C.充电时阴极的电极反应为 PbSO4(s) + 2e-="Pb(s)" + SO42-(aq) |
| D.放电时负极材料质量减小 |
如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
| A.质子透过离子交换膜由右向左移动 |
| B.铜电极应与X相连接 |
| C.M电极反应式:(C6H10O5)n + 7nH2O-24ne-= 6nCO2↑+ 24nH+ |
| D.当N电极消耗0.25 mol气体时,则铁电极增重16 g |
电瓶车所用电池一般为铅蓄电池(如图),是一种的可充电电池,电池总反应式为:
Pb+PbO2+2H2 SO4 2Pb SO4+2H2O。则下列说法正确的是
2Pb SO4+2H2O。则下列说法正确的是
| A.放电时,负极板上发生了还原反应 |
| B.放电时,正极反应是:Pb-2e一+ SO42—=PbSO4 |
| C.充电时,铅蓄电池的负极应与充电器电源的正极相连 |
| D.充电时,阳极反应是:PbSO4-2e一+2H2O= PbO2+ SO42—+4H+ |
下列说法正确的是
| A.电池充电时其正极应与外电源的负极相连而成为阴极 |
| B.氢氧燃料电池(碱性介质)的正极反应式:O2 +4e- →2O2- |
| C.粗铜精炼时,与电源正极相连的是纯铜 |
| D.铁件上镀铜时,将铁件与电源的负极相连 |
以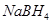 (B元素的化合价为+3)和
(B元素的化合价为+3)和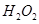 为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为
为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为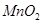 ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是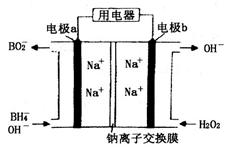
| A.该电池工作时Na+由a极区移向b极区 |
| B.电极b是原电池的正极 |
C.该电池的负极反应为: = = |
D.电路中通过6.02×1022个电子时,理论上消耗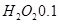 mol mol |
试题篮
()