工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是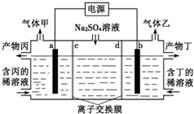
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-=H2↑+2OH- |
下列关于化学电源的有关说法中,正确的是
| A.锌锰干电池中石墨棒作负极 |
| B.氢氧燃料电池工作时,氢气在负极发生还原反应 |
| C.铅蓄电池放电时,两极质量均增加 |
| D.燃料电池的能量转化率可达100% |
某酒精检测仪是以酸性燃料电池原理设计的,负极上的反应为:CH3CH2OH-4e-+ H2O=CH3COOH + 4H+。下列有关说法不正确的是
| A.检测时,电解质溶液中的H+向正极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗2.24L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e-+ 2H2O = 4OH- |
电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
| A.锌锰干电池工作一段时间后碳棒变细 |
| B.氢氧燃料电池可将热能直接转变为电能 |
| C.氢氧燃料电池工作时氢气在负极被氧化 |
| D.太阳能电池的主要材料是高纯度的二氧化硅 |
将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流。下列叙述正确的是
①通入CH4的电极为正极;
②正极的电极反应式为:O2+2H2O+4e-=4OH-;
③通入CH4的电极反应式为:CH4+2O2+4e-=CO2+2H2O;
④负极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动.
| A.①③⑤ | B.②④⑥ | C.④⑤⑥ | D.①②③ |
科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机物转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为:
| A.H2+2OH-=2H2O+2e- | B.O2+4H++4e-=2H2O |
| C.H2 -2e-=2H+ | D.O2+2H2O+4e-=4OH- |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-==Cl2↑ |
| B.氢氧燃料电池的负极反应式:O2+2H2O+4e-==4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-==Cu2+ |
| D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-==Fe2+ |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:
Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O,由此可知,该电池放电时的负极材料是
Cd+2NiO(OH)+2H2O,由此可知,该电池放电时的负极材料是
| A.Cd(OH)2 | B.Ni(OH)2 | C.Cd | D.NiO(OH) |
下图是一个化学过程的示意图。

(1)图中甲池中OH-移向 极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为 极(填“A”或"B”),并写出此电极的反应式:____ 。
(4)乙池中总反应的离子方程式:____ 。
(5)当乙池中B(Ag)极的质量增加5.4g时,乙池的pH是 (若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是 (填序号)。
| A.MgSO4 | B.CuSO4 | C.AgNO3 | D.AlCl3 |
下列叙述不正确的是
| A.太阳能蓄电池只是将太阳能直接转化为电能的装置 |
| B.燃料电池是将化学能直接转化为电能的装置,所以能量利用率高 |
| C.碱性Zn-Mn干电池比酸性Zn-Mn干电池耐用,且不易漏液 |
| D.手机上用的锂离子电池属于二次电池 |
铅蓄电池的电池反应为 Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l),下列说法错误的是
2PbSO4(s)+2H2O(l),下列说法错误的是
| A.放电时电解质溶液的H+浓度逐渐减小 |
| B.利用铅蓄电池电解饱和食盐水制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少0.10 mol |
| C.充电时阴极的电极反应为 PbSO4(s) + 2e-="Pb(s)" + SO42-(aq) |
| D.放电时负极材料质量减小 |
如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
| A.质子透过离子交换膜由右向左移动 |
| B.铜电极应与X相连接 |
| C.M电极反应式:(C6H10O5)n + 7nH2O-24ne-= 6nCO2↑+ 24nH+ |
| D.当N电极消耗0.25 mol气体时,则铁电极增重16 g |
电瓶车所用电池一般为铅蓄电池(如图),是一种的可充电电池,电池总反应式为:
Pb+PbO2+2H2 SO4 2Pb SO4+2H2O。则下列说法正确的是
2Pb SO4+2H2O。则下列说法正确的是
| A.放电时,负极板上发生了还原反应 |
| B.放电时,正极反应是:Pb-2e一+ SO42—=PbSO4 |
| C.充电时,铅蓄电池的负极应与充电器电源的正极相连 |
| D.充电时,阳极反应是:PbSO4-2e一+2H2O= PbO2+ SO42—+4H+ |
试题篮
()