图1是金属锌板上贴上一张用某溶液浸湿的滤纸,图2是NaBH4/H2O2燃料电池工作原理示意图。下列说法中不正确的是
A.图2电池放电过程中,Na+从负极区向正极区迁移
B.图2电极负极的电极反应式为BH4--8 e-+8OH-=BH2-+6H2O
C.若用硫酸鈉和酚酞溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点处出现红色
D.若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯c点处出现蓝色,则b接的是A电极
查处酒后驾驶采用的“便携式测量仪”是以燃料电池为工作原理,在酸性环境中,乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-=X+2H+。下列说法中正确的是( )
| A.燃料电池属于二次电池 |
| B.另一极的电极反应式为:O2+4e-+2H2O=4OH- |
| C.乙醇在正极发生氧化反应 |
D.电池总反应为:2CH3CH2OH+O2 2CH3CHO+2H2O 2CH3CHO+2H2O |
纽扣式银锌电池的构造示意图如下图所示,
电池的总反应为:
下列说法不正确的是
A. 作负极 作负极 |
B.电子经外电路流向 极 极 |
C. 向 向 极移动 极移动 |
D.正极反应: |
汽车上用的铅蓄电池是以一组充满海绵状态的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。总反应为:Pb+PbO2+2H2SO4 2PbSO4+2H2O,下列叙述正确的是
2PbSO4+2H2O,下列叙述正确的是
| A.充电时阴极反应为:Pb + SO42- -2e- =PbSO4 |
| B.放电时,当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为1mol |
| C.放电时溶液中H+向负极移动 |
| D.充电时阳极附近溶液的pH减小 |
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为:CH3CH2OH – 4e-+ H2O = CH3COOH + 4H+。下列有关说法正确的是
| A.检测时,电解质溶液中的H+向负极移动 |
| B.若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C.电池反应的化学方程式为:CH3CH2OH + O2 = CH3COOH + H2O |
| D.正极上发生的反应为:O2 + 4e-+ 2H2O = 4OH- |
下图装置中X和Y均为石墨电极,电解液为500 mL某蓝色溶液,电解一段时间,观察到X电极表面有红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质完全电解后,停止电解,取出X电极,洗涤、干燥、称量,电极增重1.6 g。下列有关说法中不正确的是 ( )
| A.X电极是阴极 |
| B.Y电极产生气体的体积为0.224 L |
| C.电解后溶液的pH=1 |
| D.要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO3 |
银锌碱性电池的电解质溶液为浓KOH溶液,放电时的总反应为:
Ag2O2+2Zn+4KOH+2H2O=2K2Zn( OH )4+2Ag下列有关该电池的说法不正确的是
| A.电池放电时,正极附近溶液的碱性增强 |
B.电池放电时,负极反应为 |
C.电池充电时,阳极反应为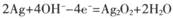 |
| D.充电时锌极与外电源正极相连 |
燃料电池能量利用率可高达80%,下列有关燃料电池的说法错误的是
| A.燃料电池的负极反应物是氢气、甲烷、乙醇等物质 |
| B.氢氧燃料电池常用于航天飞行器,产物为水经过处理之后可供宇航员使用 |
| C.乙醇燃料电池的电解质常用KOH,负极反应为C2H5OH-12e-=2CO2↑+3H2O |
| D.H2SO4作电解质,甲烷燃料电池的正极反应为O2+4H++4e-=2H2O |
LiFePO4可用于电动汽车。电池反应为:FePO4+Li LiFePO4,电解质为导电固体。下列有关LiFePO4电池的说法正确的是
LiFePO4,电解质为导电固体。下列有关LiFePO4电池的说法正确的是
| A.该电池可用水作电解质溶液 |
| B.充电时,电池内部的Li+向阳极移动 |
| C.充电阳极反应LiFePO4-e-=FePO4+Li+ |
| D.放电时正极材料的质量减少 |
某学生设计一水果电池:他把一铁钉和碳棒用导线连接好,然后将铁钉和碳棒平行插入一新鲜西红柿中,再在导线中接一个灵敏电流计.据此下列叙述正确的是
| A.电流计指针不会发生偏转 | B.金属铁会被腐蚀 |
| C.碳棒作负极 | D.铁表面有气体逸出 |
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是
| A.乙醇在电池的负极上参加反应 |
| B.1mol CH3CH2OH被氧化转移6mol e- |
| C.随着反应的进行,正极附近的酸性减弱。 |
| D.电池正极的正极反应为4H++O2+4e-=2H2O |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池工作时,电子由正极通过外电路流向负极 |
| C.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) |
| D.外电路中每通过O.2mol e-,锌的质量理论上减小6.5g |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( )中而形成的,电池总反应方程式为:
)中而形成的,电池总反应方程式为:
8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是 ( )
| A.电解质溶液中混入水,对电池反应无影响 |
| B.金属锂作电池的正极,石墨作电池的负极 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 |
| D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1 |
汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:
PbO2 (s)+Pb(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l),根据此反应判断下列叙述中正确的是
| A.PbO2是电池的负极 |
| B.负极的电极反应式为:Pb(s)+SO42(aq)–2e – = PbSO4(s) |
| C.铅蓄电池属于一次电池 |
| D.电池放电时,溶液酸性增强 |
试题篮
()