一种新燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料说法正确的是 ( )
| A.在熔融电解质中,O2-由负极移向正极 |
| B.电池的总反应是:2C4H10 + 13O2 → 8CO2 + 10H2O |
| C.通入空气的一极是负极,电极反应为:O2 + 4e- = 2O2- |
| D.通入丁烷的一极是正极,电极反应为:C4H10 + 26e- + 13O2 = 4CO2 + 5H2O |
下列陈述和判断均正确,且有因果关系的是
| 选项 |
陈述 |
判断 |
| A |
Si有良好的半导体性能 |
Si可用于制备光导纤维 |
| B |
在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成 |
说明该未知溶液含有SO42- |
| C |
铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag |
要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热 |
| D |
锌锰干电池碳棒是正极,MnO2是氧化剂 |
锌锰干电池是二次电池,可以反复充电 |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4 + 4OH- - 4e - = N2+ 4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,正极发生氧化反应,PH减小 |
以 (B元素的化合价为+3)和
(B元素的化合价为+3)和 为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为
为原料的电池,可以作为通讯卫星的高能电池。其电极负极材料为Pt/C,正极材料为 ,工作原理如图所示。下列说法不正确的是
,工作原理如图所示。下列说法不正确的是
| A.该电池工作时Na+由a极区移向b极区 |
| B.电极b是原电池的正极 |
C.该电池的负极反应为: = = |
D.电路中通过6.02×1022个电子时,理论上消耗 mol mol |
根据下图,下列判断中正确的是
| A.向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B.烧杯b中发生反应为2Zn-4eˉ =2Zn2+ |
| C.电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D.烧杯a中发生反应O2 + 4H++ 4eˉ = 2H2O,溶液pH降低 |
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构见右图,电池总反应可表示为:2H2+O2=2H2O。下列有关说法正确的是
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为:O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右下图。下列有关该氢氧燃料电池的说法错误的是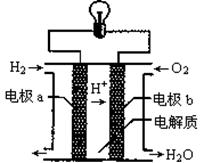
| A.该电池工作时将化学能转化为电能 |
| B.电流从电极b经外电路流向电极a |
| C.该电池中的电极b是正极 |
| D.在电极a上发生还原反应 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢或锂电池的十倍,可连续使用一个月才充一次电,其电池反应为:2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列有关说法不正确的是
2CO32-+6H2O,则下列有关说法不正确的是
| A.放电时化学能转变为电能 | B.放电时CH3OH参与正极反应 |
| C.充电时阴极产生CH3OH | D.充电时每生成1mol CH3OH,则转移6mol电子 |
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为Fe3++Cr2+ Fe2++Cr3+。下列说法一定正确的是
Fe2++Cr3+。下列说法一定正确的是
| A.充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极室穿过选择性透过膜移向正极室 |
| D.放电时,电路中每流过0.1 mol电子,Fe3+浓度降低0.1 mol·L-1 |
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(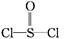 )中而形成的,电池总反应方程式为:8Li+3SOCl2
)中而形成的,电池总反应方程式为:8Li+3SOCl2 6LiCl+Li2SO3+2S,下列叙述中正确的是( )
6LiCl+Li2SO3+2S,下列叙述中正确的是( )
| A.电解质溶液中混入水,对电池反应无影响 |
| B.金属锂作电池的正极,石墨作电池的负极 |
| C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 |
| D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1 |
已知蓄电池在放电时起原电池的作用,在充电时起电解池的作用。汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成。两个电极用稀硫酸作电解质溶液。在放电时,两极发生的反应可分别表示为:
Pb+S-2e- PbSO4
PbSO4
PbO2+4H++S+2e- PbSO4+2H2O
PbSO4+2H2O
充电时,两极发生的反应分别表示为:
PbSO4+2e- Pb+S
Pb+S
PbSO4+2H2O-2e- PbO2+4H++S
PbO2+4H++S
在蓄电池生产和使用时,下列说法中正确的是( )
| A.生产和使用铅蓄电池,不会造成环境污染 |
| B.生产和使用铅蓄电池时,可能引起铅中毒和环境污染 |
| C.使用铅蓄电池时,若铅板上有1 mol铅反应就消耗1 mol H2SO4 |
| D.在使用时,电池内溶液的密度会增大 |
已知蓄电池在放电时起原电池的作用,在充电时起电解池的作用。汽车上用的铅蓄电池是以一组充满海绵状灰铅的铅板和另一组结构相似的充满二氧化铅的铅板组成。两个电极用稀硫酸作电解质溶液。在放电时,两极发生的反应可分别表示为:
Pb+S-2e- PbSO4
PbSO4
PbO2+4H++S+2e- PbSO4+2H2O
PbSO4+2H2O
充电时,两极发生的反应分别表示为:
PbSO4+2e- Pb+S
Pb+S
PbSO4+2H2O-2e- PbO2+4H++S
PbO2+4H++S
在蓄电池放电时,溶液的pH将( )
| A.不变 | B.升高 | C.降低 | D.无法确定 |
已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一
定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
| A.所得溶液中的c(H+)=1.0×10-13 mol·L-1 |
| B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1 |
| C.所加的烧碱溶液的pH=13.0 |
| D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1 |
Li-A1/FeS电池是一种正在开发的车载电池,该电池中正极电极反应式为:2Li++FeS+2e- =Li2S+Fe。有关该电池的叙述正确的是( )
| A.该电池的总反应式为:2Li+FeS=Li2S+Fe |
| B.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价 |
| C.负极的电极反应式为Al-3e-=Al3+ |
| D.充电时,阴极的电极反应式为:Li2S+Fe-2e- = 2Li++FeS |
铅蓄电池的两极分别为Pb、PbO2,电解液为硫酸,工作时的反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,下面结论正确的是( )。
| A.Pb为正极,被氧化 |
| B.溶液的pH不断减小 |
C.S 只向PbO2处移动 只向PbO2处移动 |
| D.电解液密度不断减小 |
试题篮
()