高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
 下列叙述错误的是:
下列叙述错误的是:
| A.放电时正极附近溶液的碱性增强 |
| B.放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C.充电时锌极与外电源负极相连 |
| D.充电时阳极反应为:Fe(OH)3— 3e-+ H2O |
液态肼(N2H4)-空气燃料电池的装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于该电池的叙述正确的是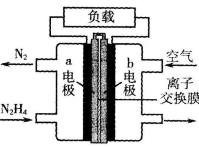
| A.b极发生氧化反应 |
| B.OH-问b极移动 |
| C.放电时,电流从a极经过负载流向b极 |
| D.a极的电极反应式:N2H4+4OH—-4e-=N2↑+4H2O |
将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。已知,通入 CH4的一极,其电极反应式是CH4+10OH--8e-===CO32-+7H2O;通入O2的另一极,其电极反应式是2O2+4H2O+8e-===8OH-。下列叙述不正确的是
| A.正极发生还原反应 |
| B.通入CH4的电极为负极 |
| C.该电池使用一段时间后应补充KOH |
| D.燃料电池工作时,溶液中的OH-向正极移动 |
RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池,RFC工作原理见图。下列有关说法正确的是
| A.转移0.1mol电子时,a电极产生标准状况下O2 1.12L |
| B.b电极上发生的电极反应是:2H2O+2e-=H2↑+2OH- |
| C.c电极上进行还原反应,B池中的H+可以通过隔膜进入A池 |
| D.d电极上发生的电极反应是:O2+4H++4e-=2H2O |
实验小组中甲同学按图完成实验,发现电流计指针偏转,乙同学将图中盐桥(琼脂和饱和氯化钾)换成U形铜丝代替盐桥,发现电流计指针也发生偏转,以下说法正确的是
| A.甲同学实验过程中,ZnSO4溶液中阴离子总浓度不会发生改变 |
| B.甲同学实验过程中,Zn片被氧化,铜片被还原 |
| C.乙同学将盐桥换成铜丝后,导线中电流方向不会发生变化 |
| D.乙同学将盐桥换成铜丝后,U形铜丝的两端电极反应类型一致 |
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
下列说法不正确的是
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.为使电池持续放电,离子交换膜需选用阴离子交换膜 |
| C.电极A极反应式为:2NH3-6e-=N2+6H+ |
| D.当有4.48LNO2(标准状况)被处理时,转移电子为0.8mol |
铁镍蓄电池其化学反应原理为:Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH) 2下列有关该电
Fe(OH)2+2Ni(OH) 2下列有关该电
池的说法不正确的是
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-===Fe(OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-===Ni2O3+3H2O |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M =" NiOOH" + MH。已知:6NiOOH + NH3 + H2O + OH-="6" Ni(OH)2 + NO2-
下列说法正确的是
| A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH- |
| B.充电过程中OH-离子从阳极向阴极迁移 |
| C.充电过程中阴极的电极反应式:H2O + M + e-=" MH" + OH-,H2O中的H被M还原 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
| A.充电时阳极反应:Ni(OH)2-e- + OH- ="NiOOH" + H2O |
| B.充电过程是化学能转化为电能的过程 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH -向正极移动 |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2+M = NiOOH+MH已知:6NiOOH+NH3+H2O+OH-=6Ni(OH)2+NO2-。下列说法正确的是
| A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH+H2O+e-= Ni(OH)2+OH- |
| B.充电过程中OH-离子从阳极向阴极迁移 |
| C.充电过程中阴极的电极反应式:H2O+M+e-= MH+OH-,H2O中的H被M还原 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
铁路氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,
工作原理为 下列说法一定正确的是
下列说法一定正确的是
| A.电池充电时,阴极的电极反应式为Cr3++e-=Cr2+ |
| B.电池放电时,负极的电极反应式为Fe2+-e-=Fe3+ |
| C.电池放电时,Cl-从负极穿过选择性透过膜移向正极 |
| D.电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1mol·L-1 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O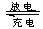 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是:
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是:
| A.放电时负极反应为: Zn-2e―+2OH―=Zn(OH)2 |
| B.充电时阳极反应为:Fe(OH)3-3e―+5OH―=FeO42-+4H2O |
| C.放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D.放电时的正极在充电时须接电源正极 |
目前已研制出一种用磺酸类质子作溶剂的酸性乙醇电池,其效率比甲醇电池高出32倍,电池构造如图所示,电池反应式为:C2H5OH+3O2=2CO2+3H2O。下列关于该电池的说法正确的是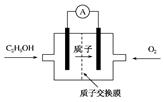
| A.通入乙醇的电极为该电池的正极 |
| B.放电过程中,电源内部的H+从正极区向负极区迁移 |
| C.该电池的正极反应为:4H++O2+4e—=2H2O |
| D.用该电池做电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2 mol C2H5OH,阴极产生标准状况下气体的体积为13.44 L |
某碱性蓄电池在充电和放电时发生的反应为:Fe+NiO2+2H2O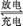 Fe(OH)2+Ni(OH)2,
Fe(OH)2+Ni(OH)2,
下列说法中正确的是
| A.放电时,负极上发生反应的物质是Fe |
B.放电时,正极反应是:NiO2+2e—+2H+ Ni(OH)2 Ni(OH)2 |
C.充电时,阴极反应是:Ni(OH)2-2e—+2OH— NiO2+2H2O NiO2+2H2O |
| D.充电时,阳极应该是镍元素化合价降低 |
试题篮
()