N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如下图所示,下列说法不正确的是
| A.通入N2的电极发生的电极反应式为:N2 + 6e- + 8H+="=" 2NH4+ |
| B.反应过程中溶液的pH会变大,故需要加入盐酸 |
| C.该电池外电路电流从通入H2的电极流向通入N2的电极 |
| D.通入H2的电极为负极,A为NH4Cl |
用酸性氢氧燃料电池(甲池)为电源进行电解的实验装置(乙池,一定条件下可实现有机物的电化学储氢)如下图所示.甲池中C为含苯的物质的量分数为10%的混合气体,D为l0mol混合气体其中苯的物质的量分数为24%(杂质不参与反应),E为标准状况下2. 8mol气体(忽略水蒸汽),下列说法正确的是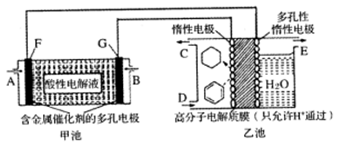
| A.甲池中A处通入H2,E处有O2放出 |
| B.甲池中H+由F极移向G极 |
| C.乙池中阴极区只有苯被还原 |
| D.导线中共传导11.2mol电子 |
【改编】用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示(a、b为铜电极)。下列说法中不正确的是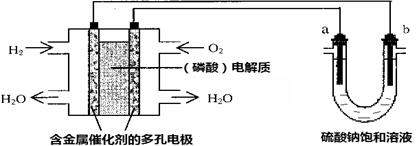
| A.电池工作时,正极反应式为:O2 + 4H++ 4e-= 2H2O |
B.电解时,当阴极逸出a mol气体,同时有W克Na2SO4•10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是 |
| C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D.忽略能量损耗,当电池中消耗0.01g O2 时,b 极周围会产生0.02g H2 |
【改编】下面是常见的电化学装置图,①②④中均为惰性电极,下列说法错误的是

| A.装置①中电解一段时间后,要恢复原溶液,应加入一定量的水。 |
| B.装置②中b极为正极,该极的电极反应方程式为O2+4H++ 4e-=2H2O |
| C.装置③中铜片为阳极,若铜片和铁制品的质量相等,电解一段时间后,电路中有2mol电子转移,此时铜片和铁制品的质量差为128g |
| D.装置④中阳极每产生标况下11.2L Cl2,则阳离子交换膜上透过1mol Na+ |
磷酸燃料电池是目前较为成熟的燃料电池之一,其基本组成及反应原理如下图所示。下列说法不正确的是
| A.该系统中不只存在化学能和电能的相互转化 |
B.在移位反应器中,反应CO(g)+H2O(g)  CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大 CO2(g)+H2(g)(ΔH>0),若温度越高,则v(CO)越大 |
| C.改质器和移位反应器的作用是将CxHy转化为H2和CO2 |
| D.该电池正极的电极反应为O2+4H+—4e-===2H2O |
生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。
已知C1极的电极反应式为:C2H5OH+3H2O-12e-===2CO2+12H+,
下列有关说法不正确的是
A.C1极为电池负极,C2极为电池正极
B.电子由C2极经外电路导线流向C1极
C.C2极的电极反应式为O2+4H++4e-===2H2O
D.该生物燃料电池的总反应式为:C2H5OH+3O2===2CO2+3H2O
【改编】磷酸铁锂电池的电池的内部结构如图所示。左边是磷酸铁锂材料作为电池的正极,由铝箔与电池正极连接,中间是聚合物的隔膜,它把正极与负极隔开,但锂离子Li+可以通过而电子不能通过,右边是由石墨组成的电池负极,由铜箔与电池的负极连接。电池的上下端之间是电池的电解质,电池由金属外壳密闭封装。电池的总反应为:

下列关于电池的说法不正确的
| A.磷酸铁锂电池放电时,锂离子从负极中脱离出来,经过电解液,穿过隔膜回到正极材料中 |
| B.放电时负极反应:LixC6-xe- ="=" 6C+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料) |
| C.充电时的阳极反应:LiFePO4 -xe-="=" Li1-xFePO4+xLi+ |
| D.若用该电池电解精炼粗铜,阳极质量减少12.8g 时,则电池中通过聚合物隔膜的Li+数为0.4NA |
如图是一种可充电的锂离子电池充、放电的工作示意图。该电池的反应式为:
LiMnO2 + C6 Li1-x MnO2 +LixC6(LixC6表示锂原子嵌入石墨形成的复合材料)下列有关说法正确的是
Li1-x MnO2 +LixC6(LixC6表示锂原子嵌入石墨形成的复合材料)下列有关说法正确的是
| A.K与N相接时,A极为负极,该电极反应式为:LixC6 - xeˉ= C6 + xLi+ |
| B.在整个充电或放电过程中都只存在一种形式的能量转化 |
| C.K与N相接时,Li+由A极区迁移到B极区 |
| D.K与M相接时,A极发生氧化反应,LiMnO2 -xeˉ = Li1-xMnO2 + xLi+ |
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式 。下列说法不正确的是
。下列说法不正确的是
| A.充电时Li+从右边流向左边 |
| B.放电时,正极锂的化合价未发生改变 |
| C.充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
如图所示是一个燃料电池的示意图,当此燃料电池工作时,下列分析中正确的是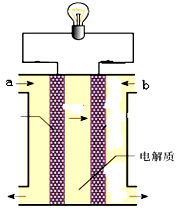
| A.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则通H2的电极上发生的反应为:H2-2e-=2H+ |
| B.如果a极通入H2,b极通入O2,H2SO4溶液作电解质溶液,则通 O2的电极上发生的反应为:O2+4e-+2H2O=4OH- |
| C.如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则通CH4的电极上发生的 反应为:CH4-8e-+10 OH-=CO32-+7H2O |
| D.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则溶液中的OH-离子向b极附近移动 |
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 ==2CO2 +3H2O,电池示意如右图,
下列说法不正确的是( )
| A.a极为电池的负极 |
| B.电池工作时电流由b极沿导线经灯泡再到a极 |
| C.电池正极的电极反应为:4H+ + O2 + 4e— = 2H2O |
| D.电池工作时,1mol乙醇被氧化时就有6mol电子转移 |
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。下列说法中不正确的是
| A.该电池的负极反应为2SOCl2 + 4e— = S +SO2+4Cl— |
| B.该电池的负极反应为4Li = 4Li+ + 4e— |
| C.反应SOCl2 + H2O = SO2↑ + 2HCl↑为非氧化还原反应 |
| D.组装该电池必须在无水的条件下进行 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.图为RFC工作原理示意图,有关说法正确的是
A. 当有0.1mol电子转移时,a极产生1.12L O2(标准状况下)
B. b极上发生的电极反应是:4H2O+4e﹣=2H2↑+4OH﹣
C. d极上发生的电极反应是:O2+4H++4e﹣=2H2O
D. c极上进行还原反应,B中的H+可以通过隔膜进入A
如图所示是一个燃料电池的示意图,当此燃料电池工作时,下列分析中正确的是
| A.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则通H2的电极上发生的反应为:H2-2e-=2H+ |
| B.如果a极通入H2,b极通入O2,H2SO4溶液作电解质溶液,则通 O2的电极上发生的反应为:O2+4e-+2H2O=4OH- |
| C.如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则通CH4的电极上发生的 反应为:CH4-8e-+10OH-=CO32-+7H2O |
| D.如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则溶液中的OH-离子向b极附近移动 |
试题篮
()