下列有关锌锰干电池的说法中正确的是:
| A.锌外壳是负极,石墨碳棒是正极材料 | B.在外电路中电子从碳棒流向锌外壳 |
| C.电流从锌流到碳棒上 | D.在电池内部阳离子从碳棒向锌片移动 |
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O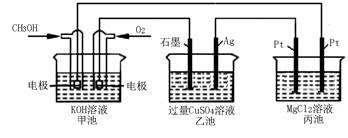
下列说法正确的是[
| A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 |
| B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=2CO32-+8H+ |
| C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度 |
| D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45g固体 |
用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成原电池——燃料电池,该电池放电时发生的反应为CH4+2KOH+2O2===K2CO3+3H2O,下列说法错误的是( )
| A.通甲烷的一极为负极,通氧气的一极为正极 |
| B.放电时,通入O2一极附近溶液的pH升高 |
| C.放电一段时间后,KOH的物质的量不发生变化 |
| D.通甲烷极的电极反应式是:CH4+10OH--8e-===CO32-+7H2O |
右图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是( ) 
| A.图1、图2中电解质溶液的pH均增大 |
| B.图2中电解AlCl3溶液的总反应为2Cl-+2H2OCl2↑+H2↑+2OH- |
| C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-===CO+7H2O |
| D.燃料电池内部OH-向a极移动,电解池中Cl-向x极移动 |
有四种燃料电池,
| A.固体氧化物燃料电池, | B.碱性氢氧化物燃料电池, | C.质子交换膜燃料电池, | D.熔融盐燃料电池,下面是工作原理示意图,其中正极反应生成水的是 |

下列说法正确的是
| A.铅蓄电池放电时铅电极发生还原反应 |
| B.电解饱和食盐水时在阳极得到氯气,阴极得到金属钠 |
| C.给铁钉镀铜可采用CuSO4作电镀液 |
| D.生铁浸泡在食盐水中发生析氢腐蚀 |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如右图所示。下列说法正确的是 
| A.电池放电时Na+从b极区移向a极区 |
| B.每消耗3 mol H2O2,转移的电子为3 mol |
| C.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
| D.该电池的负极反应为:BH4-+8OH--8e-=BO2-+6H2O |
氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。以下几种说法,正确的组合是( )
①正极反应为O2+4e-+4H+===2H2O ②负极反应为2H2+4OH--4e-===4H2O
③电池工作时正极区pH升高,负极区pH下降 ④电池工作时溶液中的阴离子移向正极
| A.①②③ | B.②③ | C.②④ | D.①④ |
CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是 
| A.a 电极发生氧化反应,b电极发生还原反应 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,说明通入的CO越多 |
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
| A.若a极是铜,b极为铁时,当电池消耗1.6gO2,b极上析出6.4g铜 |
| B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH- |
| C.若a极是粗铜,b极是纯铜时,a极减少的质量等于b极上析出铜的质量。 |
| D.若a、b两极均是石墨时,b极反应为4OH- - 4e-=O2↑+ 2H2O |
银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( )
| A.锌为正极,Ag2O为负极; | B.锌为阳极,Ag2O为阴极; |
| C.原电池工作时,负极区pH减小; | D.原电池工作时,负极区pH增大; |
下列说法不正确的是
| A.铅蓄电池在放电过程中,负极质量增加,正极质量也增加 |
| B.一定条件下,当某反应达到限度时,反应物和生成物的浓度一定相等 |
C.常温下,反应 不能自发进行,则该反应的 不能自发进行,则该反应的 |
| D.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的△H>0△S>0 |
当电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是
| A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成 |
| B.电池的正极反应式为:O2十4H+十4e-==2H2O |
| C.电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D.电池中c(KOH)不变;电解池中溶液pH变大 |
某种电池的总反应为 Fe+NiO2 + 2H2O  Fe(OH)2+Ni(OH)2。下列有关该蓄电池的说法错误的是( )
Fe(OH)2+Ni(OH)2。下列有关该蓄电池的说法错误的是( )
| A.放电时Fe是负极,NiO2是正极 |
| B.放电时正极反应是:NiO2+H2O+2e-==。Ni(OH)2+2OH- |
| C.放电时,电解质溶液中阴离子向正极方向移动 |
| D.该蓄电池的电极必须浸入某种碱性电解质溶液中 |
人造地球卫星用到的一种高能电池——银锌蓄电池,它在放电时的电极反应为:Zn + 2OH– –2e–=ZnO + H2O,Ag2O + H2O + 2e–=2Ag + 2OH–,下列叙述中,正确的是
| A.Ag2O 是负极,并被氧化 |
| B.电流由锌经外电路流向氧化银 |
| C.工作时,负极区溶液pH减小,正极区pH增大 |
| D.溶液中OH-向正极移动,K+、H+向负极移动 |
试题篮
()