(12分)有机反应中常用镍作催化剂,某化工厂收集的镍催化剂中含Ni 64.0%,Al 24.3%、Fe 1.4%,其余为SiO2和有机物。这些含镍废催化剂经乙醇洗涤后可按下列工艺流程回收镍:
已知:部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| pH |
5.2 |
3.2 |
9.7 |
9.2 |
请回答下列问题:
(1)滤液A中存在的阴离子主要是______。
(2)硫酸浸取滤渣a后,所得滤液B中可能含有的金属离子是__________。
(3)滤液B中加入H2O2的目的是_______________。操作X的名称是 。
(4)含镍金属氢化物MH-Ni燃料电池是一种绿色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液。它的充、放电反应为:xNi(OH)2+M MHx+xNiOOH
MHx+xNiOOH
电池充电过程中阳极的电极反应式为 ,放电时负极的电极反应式为 。
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比2∶1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
| A.体系压强保持不变 | B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 | D.每消耗1molSO3的同时生成1mol NO |
测得上述反应达平衡时NO2与SO2的体积比为5∶1,则平衡常数K= 。
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图(2)所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、
1.3×104kPa左右,选择此压强的理由是: 。
(3)依据燃烧的反应原理,合成的甲醇可以设计如图(3)所示的原电池装置。
① 该电池工作时,OH-向 极移动(填“正”或“负”)。
② 该电池正极的电极反应式为 。
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料。以CH4和H2O为原料制备甲醇和二甲醚的工业流程如下:
根据要求回答下列问题:
(1)“反应室1”在一定条件下反应的化学方程式为 。
(2)水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g) CH3OH(g) ΔH = -90.8kJ·mol-1
CH3OH(g) ΔH = -90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH = -23.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH = -23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) ΔH = -41.3kJ·mol-1
CO2(g)+H2(g) ΔH = -41.3kJ·mol-1
完成热化学反应方程式:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g);ΔH = 。
CH3OCH3(g)+CO2(g);ΔH = 。
(3)某科研机构研制的一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。该电池总反应为CH3OCH3+3O2=2CO2+3H2O,其工作原理如图所示。
电极a的电极反应式为 。
(14分)A、B、C、D、E、F均为短周期元素,其原子序数依次增大。已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素。根据以上信息回答下列问题:
(1)B与D形成化合物BD2的结构式为 。
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式 。FD2气体通入BaCl2和甲的混合溶液,生成白色沉淀和无色气体CD,有关反应的离子方程式为_____。
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为____________________________________;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)_______________。
(4)C2A4─空气燃料电池是一种碱性燃料电池。电解质溶液是20%~30%的KOH溶液。则燃料电池放电时:正极的电极反应式是______________;负极的电极反应式为 。
目前机动车使用的电池品种不少,其中铅蓄电池的使用量最大。
I.铅蓄电池的电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。铅蓄电池充放电的总反应方程式为:
PbO2+Pb+2H2SO4 2PbSO4+2H2O,请根据上述情况判断:
2PbSO4+2H2O,请根据上述情况判断:
(1)电池的负极材料是 。
(2)充电时,铅蓄电池阳极的电极反应式为 。
Ⅱ.铅蓄电池使用量的急速增加引起铅污染日益严重,工业上从废铅蓄电池的铅膏回收铅的一种工艺流程如下:
请回答下列问题:
(3)为提高步骤①的化学反应速率,你认为可采取的措施是 (写一条即可)。
(4)写出步骤①中PbSO4转化为PbCO3反应的平衡常数表达式:K = 。
(5)步骤①中发生氧化还原反应的化学方程式为 。
(6)步骤③从母液可获得的副产品为 (写化学式)。
(7)已知:PbCO3在一定条件下可制得PbO,PbO通过进一步反应可制得Pb,写出一个由PbO生成Pb的化学方程式: 。
铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是 (只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计的原电池,请在图甲中的横线上完成标注。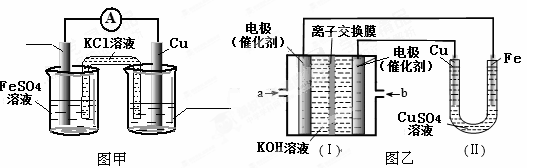
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入 (填“CH4”或“O2”),b处电极上发生的电极反应式为 ;若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后, 直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
(14分)氮、磷及其化合物在科研及生产中均有着重要的应用。
(1)某课外学习小组欲制备少量NO气体,写出铁粉与足量稀硝酸反应制备NO的离子方程式: 。
(2)LiFePO4是一种新型动力锂电池的电极材料。
①下图为某LiFePO4电池充、放电时正极局部放大示意图,写出该电池放电时正极反应方程式: 。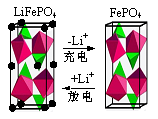
②将LiOH、FePO4·2H2O(米白色固体)与还原剂葡萄糖按一定计量数混合,在N2中高温焙烧可制得锂电池正极材料LiFePO4。焙烧过程中N2的作用是 ;实验室中以Fe3+为原料制得的FePO4·2H2O有时显红褐色,FePO4·2H2O中混有的杂质可能为 。
(3)磷及部分重要化合物的相互转化如图所示。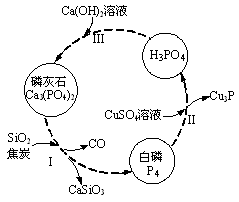
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是 。
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol CuSO4所能氧化的白磷的物质的量为 。
③步骤Ⅲ中,反应物的比例不同可获得不同的产物,除Ca3(PO4)2外可能的产物还有 。
下表是元素周期表的一部分,所列字母分别代表一种元素。
| A |
|
|
|
|
|
|
|
||||||||||
| |
|
|
|
B |
C |
D |
E |
|
|||||||||
| F |
G |
H |
|
|
|
|
|
||||||||||
| |
|
|
|
|
M |
|
|
|
N |
P |
|
|
|
|
|
|
|
(1)M元素基态原子外围电子排布式为 ;
(2)下列有关说法正确的是 (填序号);
①B、C、D元素的电负性逐渐增大
②F、G、H元素的第一电离能逐渐增大
③B、G、P三种元素分别位于元素周期表的p、s、d 区
④F、G分别与E组成的物质的晶格能,前者比后者低
⑤A、B和D以原子个数比2:1:1构成的最简单化合物分子中σ键和π键的个数比为3:1
(3)与C的最简单氢化物互为等电子体的离子是 (填化学式),写出该离子与其等电子的阴离子反应的离子方程式 ;
(4)煤矿瓦斯气体(主要成分为BA4)探测仪是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动;
①负极的电极反应式为: ;
②正极的电极反应为: ;
③传感器中通过的电流越大,表明BA4的浓度越 。
(5)已知G和稀硝酸反应,还原产物为C2D气体,若硝酸浓度再稀,则还原产物为CA3,并与过量的硝酸反应生成CA4CD3。现将9.6g G与1L1.10mol/L的稀硝酸(过量)充分反应,收集到aL气体(标准状况),同时测得溶液中c(CA4+)=0.08mol/L(假设反应前后溶液体积不变)。
①a= L。②反应后溶液pH= 。
(12分)研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s) △H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g) △H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式: 。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO2的同时生成1 molNO
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为 。(写出一种即可)。
(4)下图是一种碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极电极反应式 。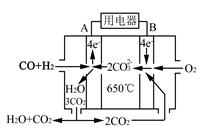
(5)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的 混合物为例)。
已知:NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
NO不能与Na2CO3溶液反应。
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为 。
②你认为Na2CO3吸收法处理氮氧化物存在的缺点是 。
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO)2Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。
(2)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有 、 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
(4)写出M与足量氢氧化钠溶液反应的化学方程式: 。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知反应Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)△H=﹣23.5kJ•mol﹣1,该反应在1000℃的平衡常数等于64。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
2Fe(s)+3CO2(g)△H=﹣23.5kJ•mol﹣1,该反应在1000℃的平衡常数等于64。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+2H2(g) CH3OH(g),请根据图示回答下列问题:
CH3OH(g),请根据图示回答下列问题:
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)= 。
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是( )
A.c1=c2 B.2Q1=Q3 C.2α1=α3 D.α1+α2=1
Ⅲ.以甲烷为燃料的新型电池,其成本大大低于以氢为燃料的传统燃料电池,目前得到广泛的研究,图三是目前研究较多的一类固体氧化物燃料电池工作原理示意图.回答下列问题:
(1)B极上的电极反应式为
(2)若用该燃料电池做电源,用石墨做电极电解100mL 1mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标况下)。
工业上将煤气化过程中生成的CO和H2在一定条件下反应制得甲醇,反应的方程式为:CO(g)+2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题: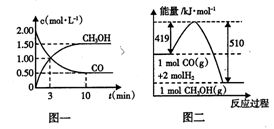
(1)从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2) =____ ;平衡时CO的转化率为____ 。
(2)该反应的平衡常数表达式为 ;若升高反应温度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
(3)若在一定温度下,向一恒压容器中充人1 mol CO、2mol H2和1 mol CH3OH,反应达到平衡时,测得混合气体的密度是同温同压下起始混合气体密度的0.8倍,则到达平衡状态前该反应向____ (填“正”或“逆”)反应方向进行。
(4)根据图二,甲醇分解的热化学方程式为 。
(5)若以甲醇为原料制成燃料电池,在碱性介质中负极的电极反应式为____ 。
CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应。目前,人们利用光能和催化剂,可将CO2和H2O(g)转化为CH4和O2。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入l L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内CH4的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
CO(g)+3H2(g) △H =" +206" kJ·mol-1。将等物质的量的CH4和H2O(g)充入l L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内CH4的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知: CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CH3OH(g) +H2O(g) △H="-49.5" kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
CO(g)+H2O(g) △H=" +" 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式 。
②该反应的△S 0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行。
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是 (填字母);理由是 。列式计算270℃时该反应的平衡常数K: 。
(4)以燃料电池为工作原理测定CO的浓度,其装置如图所示,
该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。则负极的反应式 。
关于该电池的下列说法,正确的是 。
A.工作时电极b作正极,O2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中CO的含量越高
(14分)甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上常用CO和H2反应生产CH3OH,并开发出甲醇燃料电池。
(1)已知:CO(g)+1/2O2(g)=CO2(g) △H=-283.0 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1453.0 kJ·mol-1
则CH3OH(l)不完全燃烧生成CO(g)和H2O(l)的热化学方程式为 。
(2)工业上常利用反应CO(g)+2H2(g) CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
CH3OH(g) △H<0合成甲醇,在230℃~270℃最为有利。为研究合成气最合适的起始组成比,分别在230℃、250℃和270℃进行实验,结果如图。
230℃的实验结果所对应的曲线是 (填字母);该温度下工业生产适宜采用的合成气组成n(H2):n(CO) 的比值范围是 (填字母) 。
A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:H2O(g)+CO(g) H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
H2(g)+CO2(g) △H<0,某温度下该反应的平衡常数K=1。试回答下列问题:
①该温度下,若起始时c(CO)="1" mol·L-1,c(H2O)="2" mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应v(正) v(逆)(填“>”、“<”或“=”)。
②若降低温度,该反应的K值将 (填“增大”、“减小”或“不变”)。
(4)某实验小组设计了如图所示的甲醇燃料电池装置。
①该电池工作时,OH-向 极移动(填“a”或“b”)。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
(1)已知:
甲醇制烯烃反应①:2CH3OH(g)=C2H4 (g)+2H2O(g)△H1=-29.0 KJ·mol-1
甲醇脱水反应②:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H2=-24.0 KJ·mol-1
乙醇异构化反应③:CH3CH2OH(g)=CH3OCH3(g))△H3=+50.8 KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= KJ·mol-1
(2)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ、通入氨,冷却、加食盐,过滤;Ⅱ、不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是 。而方法Ⅱ的优点是其滤液可以 。
(3)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为 :PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式 ,电解液中加入Cu(NO3)2的原因是 。
试题篮
()