锂——空气电池能够提供相当于普通锂离子电池l0倍的能量,因此它是最有前途的电池技术。下图是锂——空气电池放电和充电时的工作示意图。 
(1)图I中电极a是 极。
(2)电池中间的固体电解质(含阳离子交换膜)还能阻止H2O、N2、O2等物质的通过防止Li和这些物质反应。Li和水在常温下发生反应的化学方程式为 。
(3)当给图Ⅱ中的锂空气电池充电时,d极应接电源的 极,该电极的电极反应式为 。
(4)可用石墨为电极,用该电池电解提纯氢氧化钾电解液。电解池内的阳离子交换膜只允许阳离子通过,其工作原理如图Ⅲ所示。
①该电解池的阴极反应式为 ;
②除去杂质后的氢氧化钾溶液从出口 (填“A”或“B”)导出;
铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:PbO2 + Pb + 2H2SO4 ="=" 2PbSO4+ 2H2O,据此判断:
(1)铅蓄电池的负极材料是________。
(2)工作时正极反应为________________________________。
(3)工作时,电解质溶液的PH________(填“增大”、“减小”或“不变”)
(4)工作时,电解质溶液中阴离子移向________极;电流方向从________极流向________极。(填正,负)
随着铅蓄电池的广泛应用,使回收利用铅资源成为重要课题。某研究性学习小组利用废旧铅蓄电池阴、阳极填充物(铅膏)制备塑料加工热稳定剂三盐基硫酸铅,实验流程如下:
(1)物质X是一种可循环利用的物质,该物质是 。
(2)生成三盐基硫酸铅的反应的离子方程式为 。
(3)将滤液I和滤液Ⅱ合并后可用来提取一种钠盐副产品(相对分子质量为322),已知副产品带10个结晶水的结晶水合物,则其化学式 ,由滤液提取该副产品的主要实验步骤依次为 、 、过滤、洗涤、干燥。
(4)过滤时洗涤沉淀(或固体)的操作方法是 。
。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将PbO2还原为PbO,若实验中所取铅膏浆液质量为47.8g,其中PbO2的质量分数为15.0%,要将PbO2还原,至少需要加入
mL1.0mol·L-1Na2SO3溶液。
氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1氨水
【实验数据】(不必填表格)
| 烧杯号 |
V氨水 (mL) |
V水(mL) |
c (NH3·H2O)(mol·L-1) |
c(OH-) |
Kb |
α |
| 1 |
50.00 |
0.00 |
|
1.34×10-3 |
|
|
| 2 |
25.00 |
25.00 |
|
9.48×10-4 |
|
|
| 3 |
5.00 |
45.00 |
|
4.24×10-4 |
|
|
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1
氨水所得的滴定曲线如下:
请指出盐酸滴定氨水的曲线为 ▲ (填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 ▲ 。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= ▲ 。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2= 2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为 ▲ 。
我国首创以铝─空气─海水电池为能源的新型海水标志灯。 该灯以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光,其能量比干电池高20─50倍(海水呈弱碱性),请回答:该电源负极材料是_____,正极主要的反应物质是_____,总反应方程为:______ ______________
______________
)电子表和电子计算器的电池常用微型银—锌原电池,其电极分别为Zn和Ag2O,电解质溶液为KOH溶液,负极反应 和总反应分别为:Zn+2OH - -2e==ZnO+H2O和Ag2O+Zn==ZnO+2Ag
(1)该原电池工作时负极区溶液的PH值 (上升、下降或不变)
(2)该原电池工作时电子由 (Zn或Ag2O)极经外电路流向 (正或负)极。正极上发生的电极反应为
能源问题是当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向。
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
△H<0。在850℃时,平衡常数K=1。
(1)若降低温度到750℃时,达到平衡时K 1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3molH2O、1.0molCO2
和x molH2,则:
①当x=5.0时,上述反应向 (填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b%,则a b(填“大于”、“小于”或“等于”)
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ·mol液态水转
化为气体水吸收44kJ的热量。
(3)请写出乙醇燃烧生成气态水的热化学方程式
。
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL3mol/LNaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3) c(HCO-3)(填“大于”、“小于”或“等于”,)原因是 (用文字叙述)。
(每空2分共计8分)铅蓄电池的电极分别是PbO2和Pb,电解质溶液为稀H2SO4溶液,工作时原电池的总反应式为PbO2+Pb+2H2SO4===2PbSO4+2H2O据上述变化判断:
①原电池的负极是 (填电极材料)。电极反应式
②工作时正极反应式为
③工作时电解质溶液的c(H+)_________(填“增大”、“不变”或“减小”)
(1)有人将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
①通甲烷的铂丝为原电池的______极,发生的电极反应为____________________。
②该电池工作时(放电)反应的总化学方程式为_______________________________。
(2)X、Y、Z为三种不同短周期非金属元素的单质。在一定条件下发生如下反应: 若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式为 ;
②向苛性钠溶液中通入过量的A所发生反应的离子方程式为
③将B与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式为

I.我国即将建成自己的载人空间站。载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。
⑴某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的某极反应为:4OH--4e-=O2↑+2H2O,则另一极反应为: 。
⑵有人提出,可以设计某温度下的反应:2CO=2C+O2(△H>O、△S<O)来消除CO的污染。请你判断该温度下上述反应是否能发生并说明理由是 。
Ⅱ.大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致力“人工固氮”新方法的研究。
⑴有关大气固氮(以N2+O2  2NO为例)、人工固氮(以N2+3H2
2NO为例)、人工固氮(以N2+3H2 2NH3为例)反应的平衡常数
2NH3为例)反应的平衡常数 的值如下表。
的值如下表。
| 反应 |
N2+02  2NO 2NO |
N2+3H2 2NH3 2NH3 |
||
| 温度/℃ |
27 |
2000 |
100 |
400 |
| K |
3.84×10-31 |
0.1 |
3.4×109 |
2.0x104 |
下列说法正确的是 。(填字母)
a.大气固氮与人工固氮都是放热反应
b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
⑵已知:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  =-92.4kJ·mol-1
=-92.4kJ·mol-1
2H2(g)+02(g)="2H20(1) "  ="-571.6" kJ·mol-1
="-571.6" kJ·mol-1
据报道,在常温、常压、光照、催化剂的条件下,N2可以与水反应,则反应 N2(g)+3H20(1)=2NH3(g)+3/2O2(g)的 = KJ·mol-1。
= KJ·mol-1。
⑶某研究小组在673 K、30 MPa下,在体积为 的密闭容器中进行反应:N2(g)+3H2(g)
的密闭容器中进行反应:N2(g)+3H2(g)  2NH3(g),其
2NH3(g),其 (H2)和
(H2)和 (NH3)随时间变化的关系如图所示。
(NH3)随时间变化的关系如图所示。
①下列叙述正确的是 。(填字母)
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若t3时由673 K升至773 K,则 (H2)将增大
(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示) (H2)= 。
(H2)= 。
③若开始时 (N2)=
(N2)= (H2),则反应的平衡常数
(H2),则反应的平衡常数 = (用代数式表示)。
= (用代数式表示)。
某同学利用乙烷燃料电池进行电解实验,如图所示:
(1)一段时间后C装置的右侧碳棒附近有黄绿色气体逸出,则B装置中通入a气体为 。
(2)B装置右侧电极的电极反应式为 。
(3)C装置中左侧电极的电极反应式为 ,该极区的产物为 。
(4)当A装置中的溶液质量不再变化,B装置中理论上消耗乙烷的质量为 g。
(5)当A装置中溶液的质量不再变化,仍电解一段时间,若不考虑溶液体积的变化,此时溶液中溶质的物质的量浓度为 mol/L。
(5分)我国经济发展对能源的需求与日俱增。一种新型燃料电池是将两根特制电极插入氢氧化钾溶液中,然后从两极分别通入甲烷和氧气,其电极反应式为:
X极:CH4+10OH- -8e- ="=" CO32-+7H2O Y极:4H2O+2O2+8e- ==8OH-
( 1)、指出该电池的正极__________(X极或Y极)(1 分)
分)
(2)、在标准状况下,通入5.6L甲烷气体,完全反应后有__________mol电子转移;
(3)、该电池的电解质溶液的PH变化是__________(填升高、降低、不变)(2分)
甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ,则甲醇燃烧的热化学方程式为 。
(2)甲醇燃料电池的结构示意图如下左图。甲醇进入 极(填“正”或“负”),正极发生的电极反应为 。
(3)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H =-49.0KJ/mol
CH3OH(g)+H2O(g)△H =-49.0KJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如上右图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②该反应的平衡常数表达式为 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
甲、乙两池电极材料如图所示,请按要求回答下列问题:
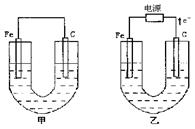
|
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2 2CO2+3H2O,制取二甲醚的反应如下:
2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO(g)+2H2(g) CH3OH(g) △H=-90.7kJ·mol-1
CH3OH(g) △H=-90.7kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式: 。
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为 极,电极反应式为
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________________________________________
②生产中可用盐酸来除铁锈。现将 一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
③下列哪个装置可防止铁棒被腐蚀_____________
④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:
A电极对应的金属是 (写元素名称),
B电极的电极反应式是 ________________
试题篮
()