(8分)电池有干电池、蓄电池、燃料电池等。
(1)手电筒使 用的是普通锌-锰电池,请写出该电池工作时发生的
用的是普通锌-锰电池,请写出该电池工作时发生的
a.正极反应_____________________________________________________
b.电池总反应___________________________________________________ (2)汽车上使用的是Pb-PbO2-H2SO4构成的可反复使用的蓄电池,请写出该电池工作时
(2)汽车上使用的是Pb-PbO2-H2SO4构成的可反复使用的蓄电池,请写出该电池工作时
a.正极反应_________________________________________
b.电池总反应_________________________________________________
(8分)某同学用铅蓄电池作电源,用石墨做电极电解500 mL某浓度的CuSO4溶液,观察到A电极表面有红色固体物质生成,当溶液中原有溶质完全电解后,停止通电,取出A电极,洗涤、干燥、称量,电极增重1.6 g。已知铅蓄电池的工作原理为:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
请按要求回答下列问题:
(1)电解CuSO4溶液的化学方程式 ,
(2)当反应过程中转移的电子为0.02mol时,铅蓄电池内消耗硫酸的物质的量为 mol。
(3)电解前CuSO4溶液的物质的量浓度为 。
(4)若电解前后溶液的体积不变,电解后溶液的pH=
(5)写出铅蓄电池负极的电极反应式:
(18分,每空3分)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42—  2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______ ______;电解液中H2SO4的浓度将变__ __;当外电路通过1 mol电子时,理论上负极板的质量增加___ ___g。
(2)电池使用一段时间后,若按图连接,则在A电极上生成___ __、B电极上生成__ __,此时铅蓄电池的正负极的极性将_ ___。(填“不变”或“对掉”)
科学家预言,燃料电池将是21世纪获得电力的重要途径,美国已计划将甲醇燃料电池用于军事目的。一种甲醇(CH3OH )燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:(11分)
)燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。回答下列问题:(11分)
(1)这种电极放电时发生的总反应是______________________________________。
(2)此电极的正极发生的电极反应式是__________________________;
负极发生的电极反应式是_______________________________。
(3)电解液中的 离子向_________极(正极或负极)移动;通入正极的气体是________.
离子向_________极(正极或负极)移动;通入正极的气体是________.
(本题16分).哥本哈根气候变化峰会自2009年12月7日开幕以来,就被冠以“有史以来最重要的会议”、“改变地球命运的会议”等各种重量级头衔。纵然世界各国仍就减排问题进行着艰苦的角力,但低碳这个概念几乎得到了广泛认同。中国慈善首富陈光标2010年11月5号创作的低碳之歌——《让我们再回到从前》让低碳概念融入到每个人的生活之中,减碳是每个人的责任。新能源开发中的燃料电池是低碳研究的重要领域。
(1)可燃性的有机物和氧气在理论上都可以作为燃料电池中的反应物,现以CxHyOz表示燃料电池中的有机反应物,O2为正极反应物,40%的KOH溶液为电解质溶液,请写出CxHyOz-O2-KOH燃料电池的负极的电极反应式: 。
(2)日本茨城大学研制了一种新型的质子交换膜二甲醚燃料电池(DDFC),该电池有较高的安全性。电池总反应为:CH3OCH3 +3O2=2CO2 +3H2O ,电池示意如图,下列说法不正确的是:
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:O2 +2H2O+ 4e— = 4OH—
D.电池工作时,1mol二甲醚被氧化时有6mol电子转移
(3)若用C3H8-O2-KOH构成燃料电池,当有11克丙烷在电池的负极完全反应,则在电池的外电路上转移的电子的物质的量为 mol;此过程中放出的总能量为A KJ,并已知1molCO2与足量KOH溶液反应放出的热量为B KJ。写出表示丙烷燃烧热的热化学方程式。 。
(4)将一定数量的C3H8-O2-KOH燃料电池按一定方式进行串联或者并联组成电池组以满足电解需要的电压。现用该电池组电解500mL某CuSO4的稀溶液,电解后的溶液需要加入98克Cu(OH)2才能使溶液恢复到原硫酸铜溶液的浓度和质量。若忽略电池组在电解过程中的能量损失,其能量全部用来电解CuSO4溶液,计算:
①原CuSO4的溶液的浓度。
②该电池组消耗的丙烷在标准状况时的体积。
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。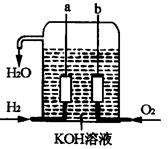
a极是 极,b极是 极,
负极反应式为: 。
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1)图中通过负载的电子流动方向 (填“向左”或“向右)
(2)写出氢氧燃料电池工作时电极反应方程式和总反应方程式
正极:_____________________负极:
总反应:____________________
(3)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和H2O反应生成H2和CO的化学方程式:
______ ____________________________
(4)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,
负极反应式为
电池总离子反应方程式为
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)右图是锌锰干电池的基本构造图,关于该电池的使用和性能,说法 正确的是
正确的是
A.该 电池可充电后反复使用
电池可充电后反复使用
B.该电池可用于闹钟、收音机、照相机等
C.该电池使用后能投入火中,也可投入池塘中
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:
已知Ni(OH)2和Cd(OH)2均难于溶于但酸,以下说法正确的是  A.以上反应是可逆反应 B.反应环境为碱性
A.以上反应是可逆反应 B.反应环境为碱性
C.电池放电时Cd做负极 D.是一种二次电池
(3)美国阿波罗的氢氧燃料电池是一种新型电源,其构造如图所示,a、b两个电极均由多孔的碳块组成,通入氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电。
①其电极为a是 极(填正或负)
②若为飞行员提供了360kg的水,则电路中通过了 mol电子。
(7分)据报道,摩托罗拉公司开发了一种以甲醇为原料,以 为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH
为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O
请填空:
(1)放电时:负极的电极反应式为____ _____。
(2)充电时:①原电池的负极与电源_________极相连。
②阳极的电极反应为__________________。
(3)在此过程中若完全反应,乙池中B极的质量升高648g,则甲池中理论上消耗 _________L(标准状况下)。
_________L(标准状况下)。
(1)科学工作者为心脏病人设计的心脏起搏器使用的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧和H+进行工作。回答下列问题:
(1)①正极材料是: ,正极反应为:
②负极材料是: ,负极反应为:
(2)写出下列反应的化学方程式:
①在催化剂条件下苯与液溴发生反应:
②乳酸(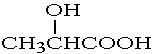 )与金属钠反应:
)与金属钠反应:
德国克莱斯公司成功研制了利用甲醇车载制氢氧燃料电池工艺,其原理如右图所示,请观察此图回答:
(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=" +" 49.0 kJ·mol-1
②2CH3OH(g)+O2(g)=2CO2(g)+4H2(g);△H=-385.8kJ·mol-1
下列说法正确的是
| A.反应①中反应物的总能量高于生成物的总能量 |
| B.反应①中拆开CH3OH(g)和H2O(g)中的化学键所需能量大于形成CO2(g)和3H2(g)中的化学键所释放的能量 |
| C.CH3OH蒸气的燃烧热为大于192.9 kJ·mol-1 |
| D.根据②推知反应:2CH3OH(l)+ O2(g)=2CO2(g)+4H2(g)的△H>-385.8kJ·mol-1 |
(2)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。若有2.2kg CO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5 kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(3)可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如右图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O。b处通入的物质是 ,负极反应为: 。
以葡萄糖为燃料的微生物燃料电池的结构如图所示。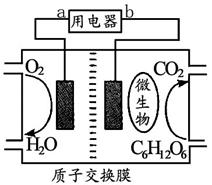
回答下列问题:
(1)该燃料电池的能量转化主要形式是 ;在导线中电子流动方向是 (用a、b表示)。
(2)该电池负极反应式是:
。
(3)葡萄糖分子中含有的官能团是: 。
该电池能否在高温下工作?理由是:
。
(4)该电池放电过程中,H+离子从 (填“正”或“负”)极区向 (填“正”或“负”)极区迁移。
(5)在该电池反应中,每消耗1molO2 ,理论上能生成标准状况下的
CO2 L。
21世纪最富有挑战性的课题之一是使汽油氧化直接产生电流,新研制的某汽油燃料电池的一个电极通入空气,另一个电极通入汽油蒸气,填写下列空格。
(1)提练汽油的原料是石油,石油是一种__________(选填“可再生”或“不可再生” )能源。
(2)汽油_____________(选填“有”或“没有” )固定的熔沸点。
(3)汽油燃料电池的能量转换形式是将________能直接转化为______能。
(4)通入空气的那个电极是燃料电池_________极(选填“正”或“负” )该电极上若有32 g O2参加反应,则反应过程中转移了_________mol e-。
近期因“召回门”而闹的沸沸扬扬的丰田Prius属第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态。
(1)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,每生成1 mol水蒸气放热569.1 kJ。则该反应的热化学方程式为_________________________________。
(2)混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解液。镍氢电池充放电原理示意如图,其总反应式是:
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH将_______(填“增大”、“不变”或“减小”),该电极的电极反应式为_________________。
(3)汽车尾气中的一氧化碳是大气污染物,可通过如下反应降低其浓度:
CO(g)+1/2O2(g)  CO2(g)。一定温度下达平衡时
CO2(g)。一定温度下达平衡时 是一个常数。
是一个常数。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请填写表中的空格。
| 容器编号 |
c(CO)/mol·L-1 |
c (O2)/mol·L-1 |
c (CO2)/mol·L-1 |
v(正)和v (逆) 比较 |
| I |
2.0×10-4 |
4.0×10-4 |
4.0×10-2 |
v(正)=v(逆) |
| Ⅱ |
3.0×10-4 |
4.0×10-4 |
5.0×10-2 |
|
②相同温度下,某汽车尾气中CO、CO2的浓度分别为1.0×10-5mol·L-1和1.0×10-4mol·L-1。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×10-4mol·L-1,则最终尾气中CO的浓度为_________mol·L-1。
高铁酸钾(K2FeO4)是一种集氧化、吸附、
絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新
型、高效、绿色环保的多功能水处理剂。近十几年
来,我国对高铁酸钾在饮用水处理中的应用的研究
也不断深入,已取得可喜成果。比较理想的制备方
法是次氯酸盐氧化法:先向KOH溶液中通入足量
Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,
得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾。
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe3++3OH-=Fe(OH)3;② 。
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物。将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4) =1.0mmol·L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO2-4)的变化,结果见下图。高铁酸钾与水反应的离子反应方程式为 ,该反应的△H 0(填“>”“<”或“=”)。
(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压。高铁电池的总反应为:
 |
3Zn+2K2FeO4+8H2O 3Zn(OH)3+2Fe(OH)3+4KOH
该电池放电时的负极反应式为 ,若外电路有5.418×1022个电子通过,则正极有 g高铁酸钾参与反应。
(4)测定某K2FeO4溶液浓度的实验步骤如下:
步骤1:准确量取V mL K2FeO4溶液加入到锥形瓶中
步骤2:在强碱性溶液中,用过量CrO-2与FeO2-4反应生成Fe(OH)3和CrO2-4
步骤3:加足量稀硫酸,使CrO2-4转化为Cr2O2-2,CrO-2转化为Cr3+,Fe(OH)3转化为Fe2+
步骤4:加入二苯胺磺酸钠作指示剂,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗(NH4)2Fe(SO4)2溶液V1mL。
①滴定时发生反应的离子方程式为 。
②原溶液中K2FeO4的浓度为 (用含字母的代数式表示)。
试题篮
()