对于反应O3+I—+H+——I2+O2+H2O(未配平),下列说法正确的是( )
| A.O2和H2O是还原产物 | B.该反应能说明O3氧化性大于I2 |
C.氧化产物与还原物的物质的量之比是1:1 |
D.配平后的化学方程式为:2O3+2I—+4H+I2+2O2+2H2O |
下列化学反应中,水既不是氧化剂又不是还原剂的是
| A.2Na2O2+2H2O===4NaOH+O2↑ | B.2F2+2H2O===4HF+O2 |
| C.2Na+2H2O===2NaOH+H2↑ | D.NaH+H2O===NaOH+H2↑ |
在稀硫酸酸化的H2O2溶液中,加入乙醚后液体分层,再加入少量K2Cr2O7溶液并振荡,在乙醚层中出现深蓝色,这是因为反应生成的CrO5溶于乙醚所致。CrO5的结构如右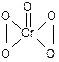 ,上述反应的离子方程式为:Cr2O72- + 4H2O2 + 2H+ ="=" 2CrO5 + 5H2O 。对以上实验事实分析中正确的是( )
,上述反应的离子方程式为:Cr2O72- + 4H2O2 + 2H+ ="=" 2CrO5 + 5H2O 。对以上实验事实分析中正确的是( )
| A.Cr2O72-被氧化为CrO5 | B.化合物CrO5中Cr为+10价 |
| C.该反应不属于氧化还原反应 | D.该反应中转移电子数为8e- |
下列反应中必须加入还原剂才能进行的是
| A.Cl2→Cl- | B.Zn→ Zn2+ | C.H2→H2O | D.CuO→CuCl2 |
已知I一、Fe2+、SO2、C1一和H2O2均具有一定的还原性,它们在酸性溶液中还原性的强弱顺序是C1一< Fe2+< H2O2 <I一< SO2,则下列反应中不能发生的是 ( )
| A.2Fe3++SO2+2H2O |
| B.SO2+I2+2H2O |
| C.H2O2+2H++SO42- |
| D.2Fe2++Cl2 |
已知还原性Cl-<Fe2+<H2O2<I-<SO2,判断下列反应不能发生的是( )
| A.2Fe3++SO2+2H2O=SO42-+4H++2Fe2+ | B.I2+SO2+2H2O=H2SO4+2HI |
| C.H2O2+2H++SO42-=SO2+O2+2H2O | D.2Fe3++2I-=2Fe2++I2 |
根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是 ( )
| A.Br-、Fe2+、I- | B.I-、Fe2+、Br- |
C.Br-、I-、Fe2+ |
D.Fe2+、I-、Br- |
下表列举的各组事实中存在因果关系的是 ( )
| 选项 |
陈述Ⅰ(原因) |
陈述Ⅱ(结果) |
| A |
O3能吸收紫外线 |
大气层中的O3被称为地球保护伞 |
| B |
钠原子核外电子数比铝少 |
钠的金属性比铝强 |
| C |
氯的非金属性比碘强 |
酸性:氢碘酸强于盐酸 |
| D |
N2+3H2 2NH3是放热反应 2NH3是放热反应 |
工业合成氨的反应在高温下进行 |
有下列三个反应:①C12+FeI2= FeC12+I2 ②2Fe2++Br2= 2Fe3++2Br—
③Co2O3+6HC1 = 2CoC12 + Cl2↑+3H2O,下列说法正确的是( )
| A.①②③中氧化产物分别是FeC12、Fe3+、C12 |
| B.根据以上方程式可以得到氧化性C12>Co2O3>Fe3+ |
| C.在反应③中生成1molCl2时,有2molHC1被氧化 |
| D.根据反应①②一定可以推理得到C12+FeBr2= FeC12+Br2 |
已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+= Fe3++Ce3+ Sn2++2Fe3+ = 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是:( )
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe3+、Sn2+、Ce3+ |
X、Y、Z为三种单质。已知:Y能将Z从其化合物的水溶液中置换出来,而Z又能将X从其化合物中置换出来。由此可以推断下列说法中可能正确的是
①单质的氧化性:Y>Z>X;
②单质的还原性:Y>Z>X;
③对应离子的氧化性:X>Z>Y;
④对应离子的还原性:X>Z>Y
| A.只有① | B.只有②③ | C.只有①④ | D.①②③④ |
将SO2 气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O===SO
气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:SO2+2Fe3++2H2O===SO +4H++2Fe2+,
+4H++2Fe2+,
Cr2O +6Fe2++14H+===2Cr3++6Fe3++7H2O。
+6Fe2++14H+===2Cr3++6Fe3++7H2O。
下列说法正确的是( )
| A.还原性:Cr3+>Fe2+>SO2 | B.氧化性:Cr2O >SO2>Fe3+ >SO2>Fe3+ |
C.Cr2O 能将Na2SO3氧化成Na2SO4 能将Na2SO3氧化成Na2SO4 |
D.两个反应中Fe2(SO4)3均作还原剂 |
工业上从硒的废料中提取硒的方法之一是用H2SO4和NaNO3处理废料,获得亚硒酸和少量硒酸。加入盐酸共热,硒酸被转化为亚硒酸(2HCl+H2SeO4==H2SeO3+Cl2+H2O),再将SO2通入亚硒酸溶液中,单质硒即析出。下列叙述正确的是 ( )
| A.H2SeO4的氧化性强于于Cl2 | B.亚硒酸氧化性强于亚硫酸 |
| C.亚硒酸的还原性强于亚硫酸 | D.析出1molSe需H2SeO3、SO2、H2O各1mol |
已知重铬酸钾(K2Cr2O7)是一种中学化学常用的强氧化剂,重铬酸钾溶液中存在如下平衡:
H+(aq)+ CrO42-(aq)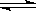 Cr2O72-(aq)+H2O。若要使溶液的橙色加深,下列可采用的方法是:
Cr2O72-(aq)+H2O。若要使溶液的橙色加深,下列可采用的方法是:
| A.加入适量稀盐酸 | B.加入适量稀硝酸 | C.加入适量烧碱固体 | D.加水稀释 |
试题篮
()