已知反应:(1)Cl2+2KBr=2KCl十Br2;(2)KClO3+6HCl=3Cl2+KCl+3H2O;
(3)2KBrO3+Cl2=Br2+2KClO3。下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.氧化性由强到弱的顺序是:KBrO3>KClO3>Cl2>Br2 |
| C.反应(2)中还原剂与氧化剂的物质的量之比为6:1 |
| D.(3)中1mol 还原剂反应则氧化剂得到电子的物质的量为2 mol |
新型纳米材料MFe2Ox(3<X<4)中,M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如下: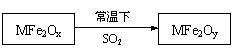
则下列判断正确的是
| A.MFe2Ox是还原剂 | B.SO2是该反应的催化剂 |
| C.X>Y | D.氧化性:MFe2Ox> SO2 |
SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:①SO2+2Fe3++2H2O===SO42—+2Fe2++4H+;②Cr2O72—+6Fe2++14H+===2Cr3++6Fe3++7H2O。下列有关说法错误的是
| A.氧化性:Cr2O72—>Fe3+>SO2 |
| B.K2Cr2O7能将Na2SO3氧化成Na2SO4 |
| C.每有1 mol K2Cr2O7参加反应,转移电子的数目为6NA |
| D.若有6.72 L SO2(标准状况)参加反应,则最终消耗0.2 mol K2Cr2O7 |
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO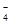 … … |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO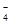 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
已知:①向KMnO4固体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸变蓝;下列判断正确的是
A.上述实验证明氧化性:MnO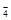 > Cl2> Fe3+ > I2 > Cl2> Fe3+ > I2 |
| B.上述实验中,共有两个氧化还原反应 |
| C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝 |
| D.实验②证明Fe2+既有氧化性又有还原性 |
已知在相同条件下进行下列反应:
①Cl2+2KBr=2KCl+Br2
②KClO3 +6HCl=3Cl2+KCl +3H2O
③2KBrO3 +Cl2=Br2 + 2KClO3,下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.反应①和反应③中均生成Br2,溴元素发生的变化相同 |
| C.反应②中被氧化与被还原物质的物质的量之比为6:1 |
| D.③中lmol还原剂反应则氧化剂得到电子的物质的量为10mol |
已知Co2O3在酸性溶液中易被还原成Co2+,且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列叙述中,正确的是:
| A.Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2=2FeCl3+4FeI3 |
| B.每1 mol Co2O3在酸性溶液中被氧化生成Co2+时转移2 mol e- |
| C.FeCl3溶液能使淀粉- KI试纸变蓝 |
| D.I2具有较强的氧化性,可以将Co2+氧化成Co2O3 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是
| A.H2O2+H2SO4 = SO2↑+O2↑+2H2O |
| B.2Fe3++SO2+2H2O= 2Fe2++SO42- +4H+ |
| C.SO2+I2+2H2O= H2SO4+2HI |
| D.Cl2+SO2+2H2O= H2SO4+2HCl |
已知 2Fe3++2I- =2Fe2++I2;2Fe2++Cl2=2Fe3++2Cl-,则有关离子的还原性由强到弱的顺序为
| A.Cl->Fe2+>I- | B.Fe2+>I->Cl- |
| C.I->Fe2+>Cl- | D.Fe2+>Cl->I- |
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4 |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4- |
Cl2、Mn2+ |
A.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
B.第①组反应的氧化产物为O2
C.第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2
D.第③组反应中生成1mol Cl2,转移电子2mol
下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是
①2HClO4+Br2(气) = 2HBrO4+Cl2
②2NaBr+Cl2= 2NaCl+Br2
③2KI+Cl2= 2KCl+I2
④2KI+Br2= 2KBr+I2
| A.①②③ | B.①②④ |
| C.②③④ | D.①②③④ |
已知反应:①Cl2+2KBr=2KCl+Br2,
②KClO3 +6HCl=3Cl2+KCl +3H2O,
③2KBrO3 +Cl2=Br2 + 2KClO3,
下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.氧化性由强到弱顺序为KClO3>KBrO3>Cl2>Br2 |
| C.反应②中还原剂与氧化剂的物质的量之比为5∶1 |
| D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
试题篮
()