已知下列反应都能发生:①2Fe3+ + 2I- = 2Fe2+ + I2 ② 2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
则有关离子氧化性强弱的顺序为
A.Cl2 > Fe3+ > I2 B Cl2 > I2 > Fe3+ C Fe3+ > Cl2 > I2 D I2> F e3+ > Cl2
e3+ > Cl2
对于反应Br2+SO2+2H2O=2HBr+H2SO4和2HBr+H2SO4(浓)=Br2+SO2↑+2H2O,下列说法中正确的是
| A.氧化性:浓H2SO4>Br2,还原性:SO2<HBr | B.它们互为可逆反应 |
| C.反应条件的改变引起了反应方向的改变,它们都符合事实 | |
| D.它们相互矛盾,不可能符合事实 |
在KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)中,下列说法错误的是
| A.HCl体现酸性和还原性 |
| B.生成1mol Cl2时,转移10mol电子 |
| C.HCl部分被氧化,被氧化HCl占参加反应HCl的5/8 |
| D.上述方程式说明还原性:KMnO4>Cl2 |
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3C  2AlN + 3CO下列叙述正确的是
2AlN + 3CO下列叙述正确的是
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂 |
| B.上述反应中每生成2molAlN,N失去6mol电子 |
| C.氮化铝中氮元素的化合价为-3 |
| D.氮化铝的摩尔质量为41g/mol |
已知 2Fe3+ +2I-=2Fe2+ +I2 、 2Fe2+ +Cl2=2Fe3+ +2Cl-;则有关离子的还原性由强到弱的顺序为
| A.Cl->Fe2+>I- | B.Fe2+>I->Cl- |
| C.I->Fe2+>Cl- | D.Fe2+>Cl->I- |
国家质检总局调查结果显示:所谓毒奶粉是被三聚氰胺所污染,它可由三聚氰酸[C3N3(OH)3]制备.三聚氰酸可用于消除汽车尾气中的NO2,已知三聚氰酸中氮元素的化合价为-3价,HCNO中N为-3价,O为-2价,有关反应原理为:
① C3N3(OH)3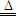 3HCNO; ② 8HCNO+6NO2
3HCNO; ② 8HCNO+6NO2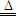 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是
| A.反应①中的两种物质互为同素异形体 | B.反应②中HCNO是氧化剂 |
| C.反应②中NO2是还原剂 | D.反应②中转移的电子数为24 |
向某溶液中加入含Fe2+的溶液后,溶液颜色无明显变化。当再滴入几滴新制氯水后,混合液变成血红色,则下列结论中错误的是
| A.原溶液中一定含有SCN- | B.氧化性:Fe3+ >Cl2 |
| C.Fe2+与SCN-不能形成红色物质 | D.Fe2+被氧化为Fe3+ |
已知:2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
K2Cr2O7+14HCl = 2KCl+2CrCl3+3Cl2↑+7H2O
MnO2+4HCl = MnCl2+Cl2↑+2H2O
其中,KMnO4和一般浓度的盐酸反应,K2Cr2O7需和较浓的盐酸(﹥6 mol·L-1)反应,MnO2需和浓盐酸(﹥8 mol·L-1)反应。以下结论中,不正确的是:
| A.上述反应既属于氧化还原反应,又属于离子反应 |
| B.生成1 mol Cl2转移电子数均为2 NA(NA为阿伏加德罗常数) |
| C.氧化性:KMnO4﹥K2Cr2O7﹥Cl2﹥MnO2 |
| D.盐酸的浓度越大,Cl-的还原性越强 |
已知下面反应可以发生: Br2 + 2NaI ="2" NaBr + I2;Cl2+ 2NaBr =" 2NaCl" + Br2则关于Cl2, Br2 ,I2氧化性强弱说法中,正确的是
| A.氧化性: I2>Br2 >Cl2 | B.氧化性: Br2 >I2>Cl2 |
| C.氧化性: Cl2 > Br2 > I2 | D.氧化性: I2>Cl2 >Br2 |
根据反应式:⑴Br2 + 2I— = 2Br- + I2 ⑵Cl2 + 2Br—= Br2+ 2Cl-可判断离子的氧化性由强到弱的顺序是
| A.Cl2、Br2、I2 | B. Br2、Cl2、I2 |
C.I2 、Cl2、Br2 | D.I2 、Br2、Cl2 |
根据反应方程式① 2Fe3+ +2I― ="=" 2Fe2+ + I2 ② 2Fe2+ +Br2 ="=" 2Fe3+ +2Br- ,可判断离子的还原性从强到弱的顺序正确的是
| A.Br->Fe2+>I- | B.I- >Fe2+ >Br- |
| C.Br- >I- >Fe2+ | D.Fe2+ >I- >Br- |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3 =bO2↑+cCl2↑+d HClO4 + eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
| A.物质HClO4的氧化性大于HClO3的氧化性 |
| B.若化学计量数a=8,b=3,则8 mol氯酸分解转移电子数为20 NA |
| C.变蓝的淀粉碘化钾试纸褪色可能是发生:4Cl2 + I2 + 6H2O = 12H+ +8Cl-+2IO3- |
| D.氯酸分解所得O2和Cl2的物质的量之比是确定不变的 |
试题篮
()