根据以下几个反应:
①Cl2+2KBr=2KCl+Br2 ②Br2+2KI=2KBr+I2 判断氧化性由强到弱的顺序是( )
| A.I2>Br2>Cl2 | B.Cl2>Br2>I2 | C.Br2>I2>Cl2 | D.Cl2>I2>Br2 |
已知I-、Fe2+、SO2、和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl-<H2O2<Fe2+<I-<SO2,则下列反应不能发生的是
| A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B.I2+SO2+2H2O=H2SO4+2HI |
| C.H2O2+H2SO4=SO2+O2↑+H2O | D.2Fe3++2I-=2Fe2++I2 |
已知常温下在溶液中可发生如下两个离子反应:Ce4++ Fe2+=Fe3++ Ce3+
Sn2++ 2Fe3+=2Fe2++ Sn4+,由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe2+、Sn2+、Ce3+ |
根据表中信息判断,下列选项不正确的是
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO4—… |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO4—>Cl2>Fe3+>Br2
根据表中信息判断,下列选项不正确的是( )
| 序号 |
反应物 |
产物 |
| ① |
KMnO4、H2O2、H2SO4 |
K2SO4、MnSO4… |
| ② |
Cl2、FeBr2 |
FeCl3、FeBr3 |
| ③ |
MnO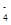 … … |
Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO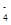 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
已知下列几个反应的化学方程式:
①2KI+Cl2=2KCl+I2;
②2FeCl2+Cl2=2FeCl3;
③2FeCl3+2HI=2FeCl2+I2+2HCl;
④I2+SO2+2H2O=H2SO4+2HI。下列有关物质的氧化性的强弱排列顺序中正确的是
| A.Cl2>Fe3+>I2>SO2 | B.Cl2>I2>Fe3+>SO2 |
| C.Cl2>Fe3+>SO2>I2 | D.Fe3+>I2>Cl2>SO2 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O===2Fe2++SO +4H+ +4H+ |
| B.I2+SO2+2H2O===H2SO4+2HI |
| C.2Fe2++I2===2Fe3++2I- |
| D.H2O2+SO2===H2SO4 |
常温下溶液中可发生如下反应:①16H++10Z-+2XO4-=2X2++5Z2+8H2O ②2A2++B2=2A3++2B- ③2B-+Z2=B2+2Z-,由此判断下列说法错误的是( )
| A.反应Z2+2A2+=2A3++2Z-可以进行 |
| B.Z元素在①③反应中均被还原 |
| C.氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
| D.还原性由强到弱顺序是A2+、B-、Z-、X2+ |
已知反应:①MnO2+4HCl PbCl2+Cl2↑+2H2O, ②Cu+2Fe3+=Cu2++2Fe2+, ③Cl2+2Fe2+=2Cl-+2Fe3+。则有关物质(离子)的氧化性由强到弱的顺序为
PbCl2+Cl2↑+2H2O, ②Cu+2Fe3+=Cu2++2Fe2+, ③Cl2+2Fe2+=2Cl-+2Fe3+。则有关物质(离子)的氧化性由强到弱的顺序为
| A.Cl2>Fe3+>Cu2+>MnO2 | B.MnO2>Cl2>Fe3+>Cu2+ |
| C.Fe3+>Cu2+>MnO2>Cl2 | D.Cu2+>Fe3+>Cl2>MnO2 |
已知氧化性顺序是:Cl2>Br2>Fe3+>I2,在FeI2和FeBr2混合溶液中,通入一定量Cl2,溶液中存在的离子组不合理的是( )
| A.Fe3+ Br— Cl— | B.Fe2+ Br— Cl— |
| C.Fe2+ Cl— I— | D.Fe2+ Br— Cl— I— |
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断正确的是
| A.化合物KCrO2中Cr元素为+3价 |
| B.实验①证明Cr2O3是酸性氧化物 |
| C.实验②证明H2O2既有氧化性又有还原性 |
| D.实验③证明氧化性:Cr2O72- > I2 |
根据下列三个反应判断有关物质(或微粒)还原性由强到弱的顺序是
①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl3+NO十+2H2O+Fe(NO3)3
| A.H2SO3 >I-> Fe2+ >NO | B.I->Fe2+> H2SO3 >NO |
| C.Fe2+ >I-> H2SO3 >NO | D.NO>Fe2+>H2SO3 >I- |
今已知反应:①Cl2+2KBr=2KCl+Br2,②KClO3 +6HCl=3Cl2+KCl +3H2O,
③2KBrO3 +Cl2=Br2 + 2KClO3,下列说法正确的是
| A.上述三个反应都有单质生成,所以都是置换反应 |
| B.反应②中还原剂与氧化剂的物质的量之比为6∶1 |
| C.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2 |
| D.③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol |
在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向溶液中加入溴水,溴单质被还原,由此可推断溶液中
| A.一定含有I-,不能含有Cl- | B.可能含有Cl-、NO3-和I- |
| C.可能含有NO3- | D.不含有Fe3+ |
试题篮
()