丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷( )脱氢制1-丁烯( )的热化学方程式如下:
① Δ H 1
已知:②
③
反应①的Δ H 1为________kJ·mol −1。图(a)是反应①平衡转化率与反应温度及压强的关系图, x_________0.1(填"大于"或"小于");欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
| A. |
升高温度 |
B. |
降低温度 |
C. |
增大压强 |
D. |
降低压强 |
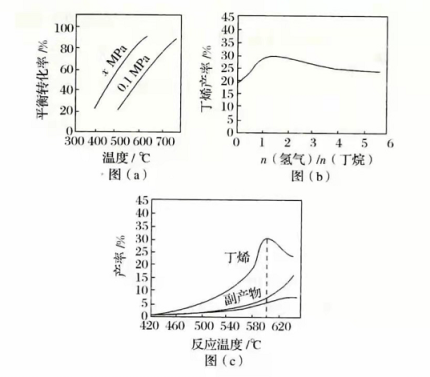
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中 n(氢气)/ n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为: 。下图为刚性容器中,进料浓度比 c(HCl) ∶ 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
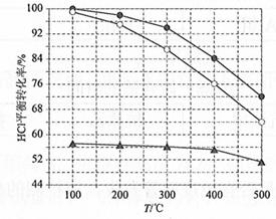
可知反应平衡常数 K(300℃)________ K(400℃)(填"大于"或"小于")。设HCl初始浓度为 , 根据进料浓度比 c(HCl)∶ c(O 2)=1∶1的数据计算 K(400℃)=________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 c(HCl)∶ 过低、过高的不利影响分别是________。
(2)Deacon直接氧化法可按下列催化过程进行:
Δ
Δ
Δ
则 的 Δ H=________ 。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
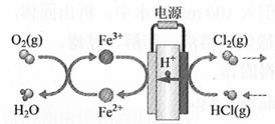
负极区发生的反应有________(写反应方程式)。电路中转移1 mol电子,需消耗氧气________L(标准状况)
催化重整不仅可以得到合成气(CO和
)。还对温室气体的减排具有重要意义。回答下列问题:
(1) 催化重整反应为: 。
已知:
该催化重整反应的 ________ 。有利于提高 平衡转化率的条件是________(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入 以及催化剂进行重整反应。达到平衡时 的转化率是50%,其平衡常数为________ 。
(2)反中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
| |
积碳反应
|
消碳反应
|
|
|
|
75 |
172 |
|
| 活化能/ |
催化剂X |
33 |
91 |
| 催化剂Y |
43 |
72 |
|
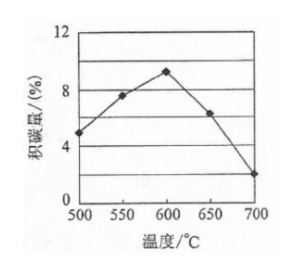
①由上表判断,催化剂X________Y(填"优于或劣于"),理由是________.在反应进料气组成,压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示,升高温度时,下列关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号)
| A. | 、 均增加 |
| B. | 减小、 增加 |
| C. | 减小、 增加 |
| D. | 增加的倍数比 增加的倍数大 |
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为 (k为速率常数)。在 一定时,不同 下积碳量随时间的变化趋势如右图所示,则 、 、 从大到小的顺序为________
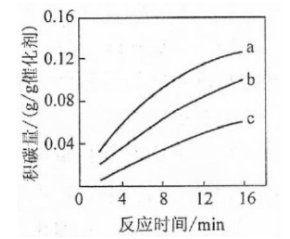
采用 为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用,回答下列问题:
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到 , 该反应的氧化产物是一种气体,其分子式为________。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时 (g)分解反应:
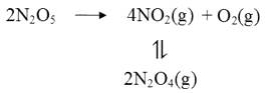
其中 二聚为 的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=x时, (g)完全分解):
| t/min |
0 |
40 |
80 |
160 |
260 |
1300 |
1700 |
∞ |
| P/kPa |
35.8 |
40.3 |
42.5 |
45.9 |
49.2 |
61.2 |
62.3 |
63.1 |
①已知:
则反应 的△H=________
②研究表明, (g)分解的反应速率 ,t=62min时,测得体系中 ,则此时的 =________ kPa,V=________ kPa, 。
③若提高反应温度至35℃,则 完全分解后体系压强 (35℃)________63.1kPa(填"大于""等于"或"小于"),原因是________。
④25℃时 反应的平衡常数 ________ kPa ( 为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应 ,R,A,Ogg提出如下反应历程:
第一步 快速平衡
第二步 慢反应
第三步 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 __________(填标号)。
| A. | ν(第一步的逆反应P>ν(第二步反应) |
| B. | 反应的中间产物只有 |
| C. | 第二步中 与 的碰撞仅部分有效 |
| D. | 第三步反应活化能较高。 |
和 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 , 还含有少量MgO、 等杂质)来制备,工艺流程如下:
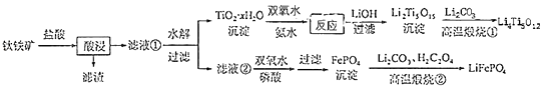
回答下列问题:
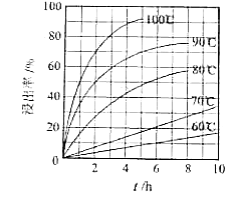
(1)"酸浸"实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为________.
(2)"酸浸"后,钛主要以 形式存在,写出相应反应的离子方程式________.
(3) 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ |
30 |
35 |
40 |
45 |
50 |
| 92 |
95 |
97 |
93 |
88 |
|
分析40℃时 转化率最高的原因________.
(4) 中Ti的化合价为+4,其中过氧键的数目为________.
(5)若"滤液②"中 , 加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中 , 此时是否有 沉淀生成?________(列式计算). 、 的分别为 、
(6)写出"高温煅烧②"中由FePO 4制备 的化学方程式________.
丙烯腈(CH 2=CHCN)是一种重要的化工原料,工业上可用"丙烯氨氧化法"生产.主要副产物有丙烯醛(CH 2=CHCHO)和乙腈(CH 3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C 3H 3N)和副产物丙烯醛(C 3H 4O)。热化学方程式如下:①C 3H 6(g)+NH 3(g)+ O 2(g)═C 3H 3N(g)+3H 2O(g)△H=﹣515kJ•mol ﹣ 1
②C 3H 6(g)+O 2(g)═C 3H 4O(g)+H 2O(g)△H=﹣353kJ•mol ﹣ 1
两个反应在热力学上趋势均很大,其原因是________;有利于提高丙烯腈平衡产率的反应条件是________;提高丙烯腈反应选择性的关键因素是________.
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃.低于460℃时,丙烯腈的产率________(填"是"或"不是")对应温度下的平衡转化率,判断理由是________;高于460℃时,丙烯腈产率降低的可能原因是________(双选,填标号).

| A. |
催化剂活性降低 |
B. |
平衡常数变大 |
| C. |
副反应增多 |
D. |
反应活化能增大 |
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示.由图可知,最佳n(氨)/n(丙烯)约为________,理由是________.进料气氨、空气、丙烯的理论体积比约为________.
【化学ーー选修2:化学与技术】
高锰酸钾( )是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为 )为原料生产高锰酸钾的工艺路线如下:
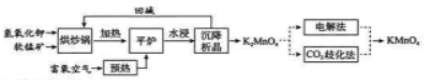
回答下列问题:
(1) 原料软锰矿与氢氧化钾按 的比例在 "烘炒锅"中混配,混配前应将软锰矿粉碎, 其作用是 。
(2) "平炉"中发生的化学方程式为 .
(3)"平炉"中需要加压,其目的是 。
(4) 将 转化为 的生产有两种工艺。
① 歧化法" 是传统工艺, 即在 溶液中通入 气体, 使体系呈中性或弱碱性,
发生歧化反应,反应中生成 和 (写化学式)。
② "电解法" 为现代工艺, 即电解 水溶液, 电解槽中阳极发生的电极反应为 , 阴极逸出的气体是_ 。
③ "电解法" 和 歧化法" 中, 的理论利用率之比为 _ 。
(5)高锰酸钾纯度的测定:称取 样品, 溶解后定容于 容量瓶中, 摇匀。取浓度为 的 标准溶液 , 加入稀硫酸酸化,用 溶液平行滴定三次, 平均消耗的体积为 , 该样品的纯度为 。
(列出计算式即可, 已知 ) 。
一氯化碘 是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1)历史上海藻提碘中得到一种红棕色液体,由于性质相似,Liebig误认为是 ,从而错过了一种新元素的发现。该元素是 。
(2)氯铂酸钡 固体加热时部分分解为 、Pt和 , 时平衡常数 。在一硬质玻璃烧瓶中加入过量 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在 ,碘蒸气初始压强为 。 平衡时,测得烧瓶中压强为 ,则 ,反应 的平衡常数 (列出计算式即可)。
(3)McMorris 测定和计算了在 范围内下列反应的平衡常数 :
得到 和 均为线性关系,如图所示:
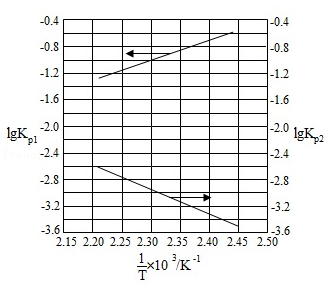
①由图可知, 分解为 和 反应的 (填"大于"或"小于")。
②反应 的 (用 表示);该反应的 (填"大于"或"小于"),写出推理过程 。
(4)Kistiakowsky曾研究了 光化学分解反应,在一定频率(v)光的照射下机理为:
其中 表示一个光子能量, 表示 的激发态。可知,分解 的 需要吸收 的光子。
二氧化碳催化加氢合成乙烯是综合利用CO 2的热点研究领域。回答下列问题:
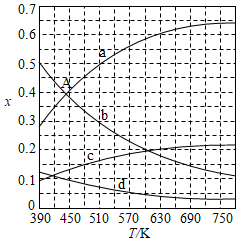
(1)CO 2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C 2H 4):n(H 2O)= 。当反应达到平衡时,若增大压强,则n(C 2H 4) (填"变大""变小"或"不变")。
(2)理论计算表明。原料初始组成n(CO 2):n(H 2)=1:3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。图中,表示C 2H 4、CO 2变化的曲线分别是 、 。 CO 2催化加氢合成C 2H 4反应的△H 0 (填"大于"或"小于")。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数K p= (MPa) ﹣ 3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C 3H 6、C 3H 8、C 4H 8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当 。
天然气的主要成分为CH 4,一般还含有C 2H 6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C 2H 6(g)═C 2H 4(g)+H 2(g)△H 1,相关物质的燃烧热数据如下表所示:
| 物质 |
C 2H 6(g) |
C 2H 4(g) |
H 2(g) |
| 燃烧热△H/(kJ•mol ﹣ 1) |
﹣1560 |
﹣1411 |
﹣286 |
①△H 1= kJ•mol ﹣ 1。
②提高该反应平衡转化率的方法有 、 。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α.反应的平衡常数K p= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH 4 C 2H 6+H 2.反应在初期阶段的速率方程为:r=k×c ,其中k为反应速率常数。
①设反应开始时的反应速率为r 1,甲烷的转化率为α时的反应速率为r 2,则r 2= r 1。
②对于处于初期阶段的该反应,下列说法正确的是 。
A.增加甲烷浓度,r增大
B.增加H 2浓度,r增大
C.乙烷的生成速率逐渐增大
D.降低反应温度,k减小
(3)CH 4和CO 2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
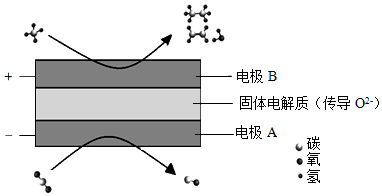
①阴极上的反应式为 。
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH 4和CO 2体积比为 。
CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO﹣,其离子方程式为 ;其他条件不变,HCO3﹣转化为HCOO﹣的转化率随温度的变化如图1所示。反应温度在40℃~80℃范围内,HCO3﹣催化加氢的转化率迅速上升,其主要原因是 。

(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为 ;放电过程中需补充的物质A为 (填化学式)。
②如图2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图3所示。
①HCOOD催化释氢反应除生成CO2外,还生成 (填化学式)。
②研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是 。
CH4与CO2重整生成H2和CO的过程中主要发生下列反应
CH4(g)+CO2(g)═2H2(g)+2CO(g)△H=247.1kJ•mol﹣1
H2(g)+CO2(g)═H2O(g)+CO(g)△H=41.2kJ•mol﹣1
在恒压、反应物起始物质的量比n(CH4):n(CO2)=1:1 条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是( )

A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800K、n(CH4):n(CO2)=1:1 条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
近期发现, 是继NO、CO之后第三个生命体系气体信号分子,它具有参与调解神经信号传递、舒张血管减轻高血压的功能.回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是(填标号).
| A. | 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| B. | 氢硫酸的导电能力低于相同浓度的亚硫酸 |
| C. | 的氢硫酸和亚硫酸的pH分别为4.5和2.1 |
| D. | 氢硫酸的还原性强于亚硫酸 |
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________、________,制得等量H 2所需能量较少的是________.
(3) 与 在高温下发反应:生 .在610k时,将 与 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02.
① 的平衡转化率 =________%,反应平衡常数K=________.
②在620K重复试验,平衡后水的物质的量分数为0.03, 的转化率 ________ , 该反应的△H________0.(填">""<"或"=")
③向反应器中再分别充入下列气体,能使 转化率增大的是________(填标号)
| A. |
|
B. |
|
C. |
COS |
D. |
|
二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
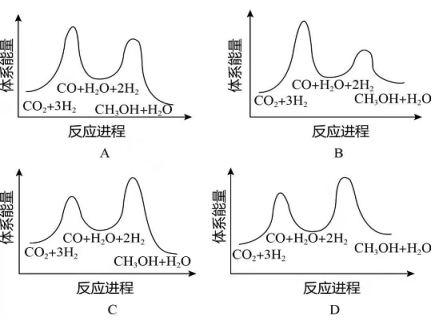
总反应的 _______ ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是________(填标号),判断的理由是_______。
(2)合成总反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在 ℃下的 、在 下的 如图所示。
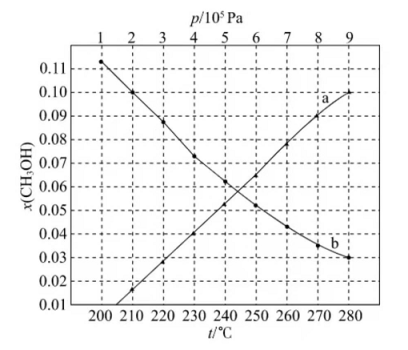
①用各物质的平衡分压表示总反应的平衡常数,表达式 ________;
②图中对应等压过程的曲线是________,判断的理由是_________;
③当 时, 的平衡转化率 __________,反应条件可能为________或_______。
试题篮
()