丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷( )脱氢制1-丁烯( )的热化学方程式如下:
① Δ H 1
已知:②
③
反应①的Δ H 1为________kJ·mol −1。图(a)是反应①平衡转化率与反应温度及压强的关系图, x_________0.1(填"大于"或"小于");欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
| A. |
升高温度 |
B. |
降低温度 |
C. |
增大压强 |
D. |
降低压强 |
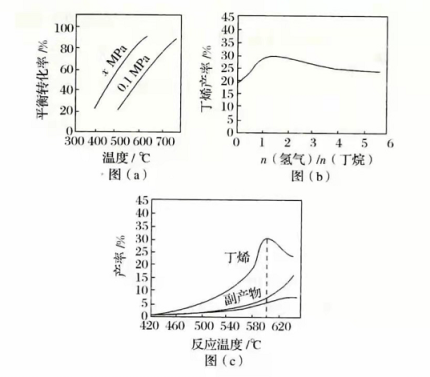
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中 n(氢气)/ n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为: 。下图为刚性容器中,进料浓度比 c(HCl) ∶ 分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
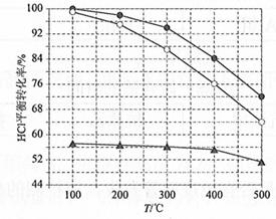
可知反应平衡常数 K(300℃)________ K(400℃)(填"大于"或"小于")。设HCl初始浓度为 , 根据进料浓度比 c(HCl)∶ c(O 2)=1∶1的数据计算 K(400℃)=________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比 c(HCl)∶ 过低、过高的不利影响分别是________。
(2)Deacon直接氧化法可按下列催化过程进行:
Δ
Δ
Δ
则 的 Δ H=________ 。
(3)在一定温度的条件下,进一步提高HCl的转化率的方法是________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
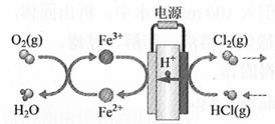
负极区发生的反应有________(写反应方程式)。电路中转移1 mol电子,需消耗氧气________L(标准状况)
采用 为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用,回答下列问题:
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到 , 该反应的氧化产物是一种气体,其分子式为________。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时 (g)分解反应:
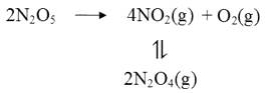
其中 二聚为 的反应可以迅速达到平衡,体系的总压强p随时间t的变化如下表所示(t=x时, (g)完全分解):
| t/min |
0 |
40 |
80 |
160 |
260 |
1300 |
1700 |
∞ |
| P/kPa |
35.8 |
40.3 |
42.5 |
45.9 |
49.2 |
61.2 |
62.3 |
63.1 |
①已知:
则反应 的△H=________
②研究表明, (g)分解的反应速率 ,t=62min时,测得体系中 ,则此时的 =________ kPa,V=________ kPa, 。
③若提高反应温度至35℃,则 完全分解后体系压强 (35℃)________63.1kPa(填"大于""等于"或"小于"),原因是________。
④25℃时 反应的平衡常数 ________ kPa ( 为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应 ,R,A,Ogg提出如下反应历程:
第一步 快速平衡
第二步 慢反应
第三步 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是 __________(填标号)。
| A. | ν(第一步的逆反应P>ν(第二步反应) |
| B. | 反应的中间产物只有 |
| C. | 第二步中 与 的碰撞仅部分有效 |
| D. | 第三步反应活化能较高。 |
和 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 , 还含有少量MgO、 等杂质)来制备,工艺流程如下:
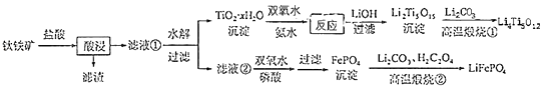
回答下列问题:
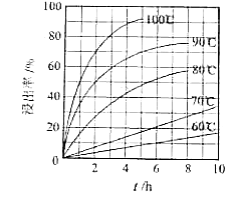
(1)"酸浸"实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为________.
(2)"酸浸"后,钛主要以 形式存在,写出相应反应的离子方程式________.
(3) 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
| 温度/℃ |
30 |
35 |
40 |
45 |
50 |
| 92 |
95 |
97 |
93 |
88 |
|
分析40℃时 转化率最高的原因________.
(4) 中Ti的化合价为+4,其中过氧键的数目为________.
(5)若"滤液②"中 , 加入双氧水和磷酸(设溶液体积增加1倍),使 恰好沉淀完全即溶液中 , 此时是否有 沉淀生成?________(列式计算). 、 的分别为 、
(6)写出"高温煅烧②"中由FePO 4制备 的化学方程式________.
CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO﹣,其离子方程式为 ;其他条件不变,HCO3﹣转化为HCOO﹣的转化率随温度的变化如图1所示。反应温度在40℃~80℃范围内,HCO3﹣催化加氢的转化率迅速上升,其主要原因是 。

(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图2所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为 ;放电过程中需补充的物质A为 (填化学式)。
②如图2所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图3所示。
①HCOOD催化释氢反应除生成CO2外,还生成 (填化学式)。
②研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是 。
近期发现, 是继NO、CO之后第三个生命体系气体信号分子,它具有参与调解神经信号传递、舒张血管减轻高血压的功能.回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是(填标号).
| A. | 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| B. | 氢硫酸的导电能力低于相同浓度的亚硫酸 |
| C. | 的氢硫酸和亚硫酸的pH分别为4.5和2.1 |
| D. | 氢硫酸的还原性强于亚硫酸 |
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理.

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为________、________,制得等量H 2所需能量较少的是________.
(3) 与 在高温下发反应:生 .在610k时,将 与 充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02.
① 的平衡转化率 =________%,反应平衡常数K=________.
②在620K重复试验,平衡后水的物质的量分数为0.03, 的转化率 ________ , 该反应的△H________0.(填">""<"或"=")
③向反应器中再分别充入下列气体,能使 转化率增大的是________(填标号)
| A. |
|
B. |
|
C. |
COS |
D. |
|
试题篮
()