室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
B.溶液中 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mLpH=11的NaOH溶液,混合液的pH=7 |
将0.20mol·L-1的NH3·H2O溶液和0.10mol·L-1的HCl溶液等体积混合,充分反应后,下列有关该溶液中各粒子浓度的关系不正确的是 ( )
| A.c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B.c(Na+)+c(H+)=c(Cl-)+c(OH-) |
| C.c(NH4+)+c(NH3·H2O)=0.10mol·L-1 |
| D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是 ( )
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)= mol·L-1 mol·L-1 |
| D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
下列说法正确的是
A.c(H+)= 的溶液一定呈中性 的溶液一定呈中性 |
| B.将水加热,KW增大,pH不变,仍呈中性 |
| C.向水中加入少量碳酸氢钠固体,溶液的c(H+)增大,平衡逆向移动,KW减小 |
| D.向0.01 mol•L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小 |
某同学用中和滴定法去测定某烧碱的纯度,实验过程如下:
(1)配制待测液称取得 5.0g 固体烧碱样品(杂质不与酸反应)配制成 250 mL 溶液,
(2)用 0.2000 mol·L-1标准盐酸滴定待测烧碱溶液,实验操作如下
| A.用碱式滴定管取上述烧碱溶液10.00 mL,注入锥形瓶中,加入指示剂。 | B.用待测定 的溶液润洗碱式滴定管。 | C.用蒸馏水洗干净滴定管。 | D.取下酸式滴定管用标准的盐酸 溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~ 3 cm处,再把酸式滴定管固定好, 调节液面至刻度“0”或“0”刻度以下。E.检查滴定管是否漏水。F.另取锥形瓶,再重复 操作一次。G.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面的刻度。 |
①滴定操作的正确顺序是(用序号填写):________________
②该滴定操作中应选用的指示剂是:________________
③在G操作中如何确定终点?________________
(3)数据处理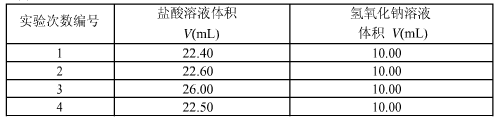
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为__________,烧碱的纯度为_________。
(4)下列操作,会导致实验结果偏低的是________(填序号)。
①碱式滴管用蒸馏水洗净后没有用待测液润洗 ②锥形瓶用蒸馏水洗净后没有用待测液润洗 ③终点读数时俯视(滴定前读数准确) ④酸式滴定管尖端气泡没有排除,滴定后消失 ⑤振荡时锥形瓶中液滴飞溅出来 ⑥酸式滴定管用蒸馏水洗净后没有用标准液润洗
欲用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,下列有关说法正确的是
| A.滴定管在装溶液前,先用蒸馏水洗涤干净后,再用待装溶液润洗 |
| B.锥形瓶在装待测溶液前,先用蒸馏水洗涤干净后,再用待装溶液润洗 |
| C.滴定过程中,两眼注视滴定管装液面的变化 |
| D.装标准液的滴定管中有气泡而滴定前未排出,则滴定结果将偏低 |
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB- H++B2- ,则下列说法中一定正确的是
H++B2- ,则下列说法中一定正确的是
A、在Na2B溶液中一定有:c(OH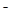 )=c(H
)=c(H )+c(HB
)+c(HB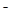 )+2c(H2B)
)+2c(H2B)
B、NaHB溶液可能存在以下关系:c(Na )>c(HB
)>c(HB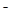 )>c(OH
)>c(OH )>c(H
)>c(H )
)
C、NaHB水溶液中一定有:c(Na )+c(H
)+c(H )=c(HB
)=c(HB )+c(OH
)+c(OH )+c(B
)+c(B )
)
D、NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
25℃时,水的电离达到平衡:H2O H++OH-;DH>0,则下列叙述正确的是
H++OH-;DH>0,则下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
用0.1000mol·L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A.酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 |
| B.应该选择酚酞作指示剂 |
| C.滴定过程中眼睛应始终注视滴定管内液面变化 |
| D.读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
某温度下,水的离子积约为10-12,将Va L pH=2的硫酸溶液与Vb L pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va∶Vb为( )
| A.2∶11 | B.11∶2 | C.9∶2 | D.2∶9 |
将pH=l的盐酸平均分成2份,l份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为: ( )
| A.9 | B.10 | C.11 | D.12 |
在一定温度下,向饱和苛性钠溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列有关说法中,正确的是
| A.溶液中Na+浓度增大,有O2放出 |
| B.溶液的碱性不变,有H2放出 |
| C.溶液中Na+数目减少,有O2放出 |
| D.溶液的碱性不变,有O2放出 |
下列叙述不正确的是
| A.在稀盐酸中c(H+)=c(OH-)+c(Cl-) |
B.常温下,在0.1 mol/l的HNO3溶液中由水电离出的c(H+)< |
| C.如果Na2Y的水溶液显中性,该溶液中一定没有电离平衡 |
| D.热水中加入氯化钠溶解至饱和,此时溶液的pH小于7 |
试题篮
()