部分弱酸的电离平衡常数如下表:
| 弱酸 |
H2CO3 |
H2SO3 |
HClO |
| 电离平衡常数 (25℃) |
K1=4.30×10-7 K2=5.61×10-11 |
K1=1.54×10-2 K2=1.02×10-7 |
K=2.95×10-8 |
下列说法不正确的是( )
A.NaHSO3溶液中的离子浓度大小为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
B.相同温度时三种溶液的pH关系:Na2CO3>NaClO>Na2SO3
C.ClO-+CO2+H2O=HClO+HCO3-
D.2ClO-+SO2+H2O=2HClO+SO32-
室温下,pH相关2的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )

A.取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗酸溶液的体积相同
B.用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7
C.稀释前两溶液中H+浓度的大小关系:A=10B
D.稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L
过氧化氢的水溶液称为双氧水,常用作消毒剂、杀菌、漂白及工业生产原料等。
某实验小组取一定量的过氧化氢溶液,测定H2O2的含量,并探究H2O2的某些性质、应用。
Ⅰ.测定市售过氧化氢溶液中H2O2的质量分数
(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用仪器是_______(填序号);
A.10mL量筒 B.酸式滴定管 C.碱式滴定管 D.50mL烧杯
(2)将上述溶液稀释至250mL,操作中用到的玻璃仪器是:烧杯、玻璃棒、_________(填名称);
(3)取25.00mL(2)中稀溶液至锥形瓶中,加适量稀硫酸酸化,用c mol/L KMnO4标准液滴定,
①完成反应的离子方程式:____MnO4-+___H2O2+___H+→___Mn2++___H2O+___;
②该小组一共进行了四次测定实验,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 消耗KMnO4溶液体积/mL |
25.00 |
25.02 |
20.00 |
24.98 |
根据所给数据,计算原过氧化氢溶液中H2O2质量分数____________________________。
(4)下列操作会导致测定结果偏高的是_____________。
A.滴定前滴定管尖嘴中有气泡,滴定的气泡消失
B.将H2O2溶液稀释成250.00mL溶液时,定容俯视刻度线
C.终点时,滴入一滴KMnO4溶液,溶液呈红色,向红色溶液返滴一滴H2O2溶液仍呈红色
Ⅱ.探究H2O2的性质
(5)上述测定原理,H2O2体现__________性;
(6)若要验证H2O2不稳定性,操作是____________________________。
Ⅲ.探究H2O2的应用
(7)为研究工业生产流程中双氧水的用量、调节的pH、反应时间三个关键生产条件对产品质量的影响,需要进行七组实验,若实验序号1是该流程的理论最佳生产条件,请在下表中填入实验序号为5、6、7的三组实验条件。
| 实验序号 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
| 双氧水(mL) |
0.5 |
0.4 |
0.6 |
0.5 |
|
|
|
| pH |
11 |
11 |
11 |
10 |
|
|
|
| 反应时间 |
3 |
3 |
3 |
3 |
|
|
|
金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值: (列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如右图所示。下列有关说法错误的是( )
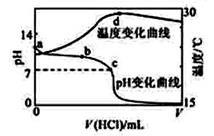
A.室温下,a点的氨水电离常数为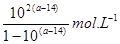 |
| B.将此氨水稀释,溶液的导电能力减弱 |
| C.c点时消耗盐酸体积V(HCl)<20 mL |
| D.a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。

(1)95 ℃时水的电离平衡曲线应为 (填“A”或“B”),理由是 。
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH 7。
(3)在曲线B所对应的温度下,将0.02 mol·L-1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH= 。
用0.2000 mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“ 0”或“0”刻度线稍下,并记下读数;④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数。⑥重复以上滴定操作2-3次。请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_________ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00 mL待测液应使用________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“偏大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视____________;判断到达滴定终点的依据是:________。
(4)以下是实验数据记录表

从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.锥形瓶用待测液润洗 |
| C.NaOH标准液保存时间过长,有部分变质 |
| D.滴定结束时,俯视计数 |
(5)根据表中记录数据,通过计算可得,该盐酸浓度为:____________mol/L
中学化学常见的滴定法包括中和滴定法、氧化还原滴定法等。
I.(1)探究小组甲用酸性KMnO4溶液滴定某补血剂[主要成分硫酸亚铁晶体(FeSO4•7H2O)]中铁元素的含量。
①下列滴定装置中(夹持部分略去),最合理的是: (填字母序号)。

②实验前,首先要准确配制一定物质的量浓度的酸性KMnO4溶液250mL,配制时需要的仪器除托盘天平、药匙、玻璃棒、烧杯、量筒外,还需要 (填仪器名称)。
Ⅱ.探究小组乙测定NH3•H2O的浓度及电离平衡常数Kb
常温下,探究小组量取25.00mL氨水至锥形瓶中,用0.0500 mol•L-1HCl滴定。用pH计采集数据, 溶液的pH随加入盐酸体积的变化曲线如图所示。

(2)如图:a>7.0的理由是(用电离方程式表示) 。
(3)如图,当加入稀盐酸的体积为22.40mL时,此时溶液中c(Cl—) c(NH4+)(填<、>或=)。
当加入稀盐酸的体积至b点溶液中离子浓度大小关系为_________。
(4)结合图信息,计算氨水的浓度为 mol•L-1;写出NH3•H2O电离平衡常数Kb的表达式,Kb= 。
(5)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水不影响测定结果 |
| B.锥形瓶未用氨水进行润洗会导致测得氨水的浓度偏低 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏高 |
实验题
I.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的离子方程式有 ;
(2)实验室中现有Na2SO4、MgSO4、FeSO4、K2SO4等4种溶液,可与实验中CuSO4溶液起相似作用的是 ;
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
| 实验 混合溶液 |
A |
B |
C |
D |
E |
F |
| 4mol/LH2SO4/mL |
30 |
V1 |
V2 |
V3 |
V4 |
V5 |
| 饱和CuSO4溶液/mL |
0 |
0.5 |
2.5 |
5 |
V6 |
20 |
| H2O/mL |
V7 |
V8 |
V9 |
V10 |
10 |
0 |
①完成此实验设计,其中:V1= ,V6= ,V9=
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因 。
Ⅱ、某兴趣组进行下列实验测定某稀硫酸的质量分数,选用酚酞做指示剂。
操作①:取5.00 mL稀H2SO4溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释;
操作②:用0.1000 mol/LKOH标准溶液滴定;
操作③:用同样方法滴定,4次消耗KOH溶液的体积分别为20.00 mL、19.98 mL、20.02 mL、20.40 mL。
请回答下列问题:
(4)如何判定滴定终点:______________________________________________。
(5)在上述实验中,下列操作会造成测定结果偏高的有________(填序号)。
A.锥形瓶用待测液润洗
B.量取稀H2SO4溶液的滴定管用蒸馏水洗净,未用稀H2SO4溶液润洗
C.滴定速度过快,又未摇匀,停止滴定后发现红色褪去
D.滴定前读数时平视,滴定终点读数时仰视
(6)分析数据,计算稀H2SO4溶液中溶质的质量分数为_________ (保留三位有效数字)。
硫酸铵是常见的化肥,是强酸弱碱盐,室温下,可用酸碱滴定法测定其氮元素的含量,但由于NH4+的酸性太弱(Ka=5.6×10-10),直接用NaOH标准溶液滴定有困难,生产和实验室中广泛采用甲醛法测定铵盐中的含氮量。甲醛法是基于甲醛与一定量铵盐作用,生成酸(H+)和六次甲基四铵盐(Ka=7.1×10-6)反应如下:4NH4++ 6HCHO=(CH2)6N4H++ 6H2O+ 3H+,生成物可用酚酞为指示剂,用NaOH标准溶液滴定[在室温下(25℃),通常Ka表示弱酸的电离平衡常数,Kb表示弱碱的电离平衡常数]。硫酸铵含氮量的测定步骤如下:
①准确称取1.800g (NH4)2SO4于烧杯中。
②用适量蒸馏水溶解,然后定量地移至250mL容量瓶中,并用蒸馏水稀释至刻度,摇匀备用。
③用移液管移取试液25mL于锥形瓶中,加入8mL 1:1的甲醛溶液,再加入1~2滴酚酞指示剂摇匀,静置一分钟后,用0.100 mol/L NaOH标准溶液滴定至溶液呈浅红色持续半分钟不褪色,即为终点。
④记录读数,平行做2~3次,NaOH标准溶液滴定消耗的平均体积为27.00mL。
根据实验回答下列问题:
(1)硫酸铵水溶液呈酸性的原因是__________________________________。(用离子方程式说明)
(2)步骤①称取硫酸铵固体样品是否能使用托盘天平______________(填“是”或“否”)。
(3)步骤③加入的甲醛溶液使用前需要加入一定量的NaOH,原因是________________________。
(4)NH4NO3中氮的百分含量是否能用该方法测定______________(填“是”或“否”)。原因是
_________________________________。
(5)据题目给出的信息计算样品中氮的百分含量为_________________ ____。
(6)若室温下,C mol/L氨水的电离平衡常数为Kb,则该氨水的电离度a=_________ ____。(用C
和Kb表示),由此在恒定温度下,你能得出的结论为_________________ ____。
(12分) ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。但二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。
(1)欧洲国家主要采用氯酸钠氧化浓盐酸制备ClO2,缺点主要是产率低,产品难以分离,还产生毒副产品。该反应的化学反应方程式为: 。科学家又研究出了一 种新的制备ClO2的方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是 。
(2)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2 S2 O3溶液.(已知:2S2O32-+I2=S4O62-+2I-)
III.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示。
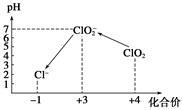
请回答:
①操作I中反应的离子方程式是 。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是 。
③若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10一3mol/L的Na2S2O3溶液10 mL,则水样中ClO2的浓度是 mg/L。
25℃时,用0.1000mol·L-1NaOH溶液滴定20mL0.1000mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是
A.当滴入40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
B.当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+)
C.当滴入NaOH溶液20mL时c(OH-)>c(H+)+c(HA)
D.当滴定到pH=4.75时,c(A-)=c(HA)
下列图示与对应的叙述相符的是
| A.由图1所示曲线可知,化学催化比酶催化的效果好 |
| B.在H2S溶液导电性实验中,由图2所示曲线可确定通入的气体X可能是SO2,不可能为Cl2 |
C.在其它条件不变时,2SO2(g)+ O2(g)  2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 2SO3(g)转化关系(图3)中,纵坐标表示O2的转化率 |
| D.图4是用0.l000 mol/L的盐酸滴定20.00 mL 0.l000mol/LNa2CO3溶液的曲线,从a→b点反应的离子方程式为:CO32--+2H+=CO2↑+H2O |
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是
| A.a点由水电离出的c(H+)=1.0×10-14mol·L-1 |
| B.b点:c(NH)+c(NH3·H2O)=c(Cl-) |
| C.c点:c(Cl-)=c(NH) |
| D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
试题篮
()