12分)许多尾气中含有NOX、SO2等造成空气污染的气体。根据要求回答下列问题:
(1)已知:NO2(g)+CO (g)  CO2 (g) +NO (g)。
CO2 (g) +NO (g)。
①密闭容器中发生该反应时,c(CO2)随温度(T)变化曲线如图所示。据此判断,升高温度,该反应的平衡常数 (选填“增大”、“减小”“不变”)。
②NO对臭氧层破坏会起催化作用,其主要过程为:Ⅰ.O3 O+O2
O+O2
Ⅱ.NO+O3 →NO2+O2
Ⅲ. 。(请写出“Ⅲ”中的化学反应方程式。)
(2)将CO2和H2合成二甲醚(CH3OCH3)已取得了较大的进展,其化学反应为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①1g二甲醚气体完全燃烧生成两种气态氧化物,放出能量q kJ,请写出该反应的热化学方程式 ;
②二甲醚可以作为燃料电池的燃料,若用硫酸做电池中的电解质溶液,请写出该燃料电池工作时负极电极反应式 。
(3)室温条件下,用0.10mol·L-1盐酸分别滴定20.00mL浓度均为0.10mol·L-1的NaOH溶液和氨水,下图是滴定其中一种溶液时,所得混合液的pH与加入盐酸体积的关系曲线图。
①该曲线表示滴定 (填“NaOH”或“氨水”)的过程;
②当向20.00mLNaOH溶液中加入v mL盐酸时,所得混合溶液pH=12,则v = 。(保留2位小数)
以下是对化学反应变化过程及结果的研究。按要求回答问题:
(1)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应C2H5OH(g)=CH3OCH3(g))△H3=+50.7kJ·mol-1
则乙烯气相直接水合反应
C2H4 (g)+H2O(g)=C2H5OH(g)的△H= 。
(2)在25℃下,将pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,若两溶液恰好完全反应,则a+b________14(填“>”、“<”或“=”);该温度下醋酸的电离常数K=__________(用含a、b的式子表示)。
(3)用一个离子方程式表示反应:100ml 3mol·L-1NaOH溶液中通入标准状况下4.48LCO2 ;所得溶液中离子浓度大小排列顺序为: ;
(4)废氨水可以转化成氨,氨再设计成碱性燃料电池。下图是该燃料电池示意图,产生的X气体可直接排放到大气中。
a电极电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
(1)一定温度下,向1 L 0.1 mol·L-1 CH3COOH溶液中加入0.1 mol CH3COONa固体,则醋酸的电离平衡向________(填“正”或“逆”)向移动;溶液中 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3·H2O。
已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;
b.CH3COOH+NaHCO3 CH3COONa+CO2↑+H2O。
CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈________性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
(3)99 ℃时,Kw=1.0×10-12,该温度下测得0.1 mol·L-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_____________________________。
②该温度下,将0.01 mol·L-1 H2A溶液稀释到20倍后,溶液的pH=________。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气_____。
| A.盐酸多 | B.H2A多 | C.一样多 | D.无法确定 |
④将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为_______________________________________。
Ⅰ.通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+====I2+Z+H2O常作为Y的鉴定反应。W是短周期元素,最外层电子数是最内层电子数的三倍,吸引电子对的能力比X单质的组成元素要弱。
(1) Z的化学式__________________
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别Y和二氧化硫的实验方法:________________________________________________________。
(3)举出实例说明X的氧化性比W单质氧化性强(仅用一个化学方程式表示):_____________。
Ⅱ.如图是0.1 mol·L-1四种电解质溶液的pH随温度变化的图像。
(1)其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),
(2)20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=________。(计算精确值)
(3)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示: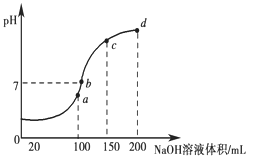
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________________
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)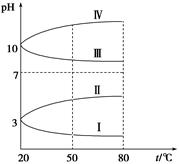
如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= 。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
现有0.175mol/L醋酸钠溶液500mL(已知醋酸的电离常数Ka=1.75x10 )
)
(1)写出醋酸钠水解反应的化学方程式_____________________。
(2)下列图像能说明醋酸钠的水解反应达到平衡的是_____________________。
 |
 |
 |
 |
| A.溶液中c (Na+)与反应时间t的关系 |
B.CH3COO-的水解速率与反应时间t的关系 |
C.溶液的PH与反应时间t的关系 |
D.KW与反应时间t的关系 |
(3)在醋酸钠溶液中加入下列少量物质,水解平衡向正反应方向移动的有
A.冰醋酸 B.纯碱固体 C.醋酸钙固体 D.氯化铵固体
(4)在醋酸钠溶液中加入少量冰醋酸后,溶液中微粒浓度的关系式能成立的有
A.c(CH3COO-)+c(CH3COOH)>c(Na+)
B.c(Na+)+c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.c(CH3COO-)>c(H+)>c(OH-)>c(Na+)
(5)欲配制0.175mol/L醋酸钠溶液500mL,可采用以下两种方案:
方案一:用托盘天平称取_______g无水醋酸钠,溶于适量水中,配成500mL溶液。
方案二:用体积均为250 mL且浓度均为________的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
(6)在室温下,0.175mol/L醋酸钠溶液的PH约为________(已知醋酸根的水解反应的平衡常数K=Kw/Ka(CH3COOH))。
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1。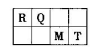
(1)人的汗液中台有T的简单离子,其离子结构示意图为_________________;元素M在元素周期表中的位置是___________________。
(2)R的最高价氧化物所含的化学键类型是__________键(选填“离子”或“共价”)。
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为__________(用具体的化学式表示)。
(4)在一定条件下甲、乙、丙有如下转化:甲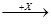 乙
乙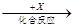 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
①R ②Q2 ③M ④T2
(5)工业上,常利用。RO与MO2反应生成固态M单质和RO2,从而消除这两种气体对大气的污染。
已知:2RO(g)+O2(g)=2RO2(g) △H=-akJ·mol-l
M(s)+O2(g)=MO2(g) △H=-bkJ·mol-l
则反应2RO(g)+MO2(g)=2RO2(g)+M(s) △H=___________。
(6)元素T的含氧酸HTO具有漂白性。往20mL 0.0lmol·L-l的HTO溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示。据此判断:该烧碱溶液的浓度为______________mol·L-l;下列有关说法正确的是_______________。
①HTO的电离常数:b点>a点
②由水电离出的c(OH—):b点<c点
③从a点到b点,混合溶液中可能存在:c(TO—)= c(Na+)
④从b点到c点,混合溶液中一直存在:c(Na+)>c(TO-)>c(OH-)>c(H+)
Ⅰ.铜铁及其化合物在日常生活中应用广泛,某研究性学习小组用粗铜(含杂质Fe)与过量氯气反应得固体A,用稀盐酸溶解A,然后加试剂调节溶液的pH后得溶液B,溶液B经系列操作可得氯化铜晶体,请回答:
(1)固体A用稀盐酸溶解的原因是 __。
(2)检验溶液B中是否存在Fe3+的方法是 __。
(3)已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是 。
Ⅱ.常温下,某同学将稀盐酸和氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
氨水物质的量浓度/(mol·L-1) |
盐酸物质的量浓度/(mol·L-1) |
混合溶液pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH>7 |
请回答:
(4)从第①组情况分析,该组所得混合溶液中由水电离出的c(H+)= __mol·L-1;从第②组情况表明,c __(填“>”“<”或“=”)0.2 mol·L-1;从第③组情况分析可知,混合溶液中c(NH4+) __(填“>”“<”或“=”)c(NH3·H2O)。
(5)写出以下四组溶液NH4+浓度由大到小的顺序 __> __> __> __(填选项编号)。
A.0.1 mol·L-1 NH4Cl
B.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 NH3·H2O
C.0.1 mol·L-1 NH3·H2O
D.0.1 mol·L-1 NH4Cl和0.1 mol·L-1 HCl
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;
若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。
(已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39)
(5)该工艺流程中,可以循环利用的物质有 和 。
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
| A.Ba(NO3)2 | B.BaCl2 | C.Ba(OH)2 | D.溶有NH3的BaCl2溶液 |
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为 。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH1=+489.0 kJ·mol-1
C(石墨)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________________________
②利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式___________________________________________
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
测得CH3OH的物质的量随时间变化如上图所示,回答问题:
①下列措施中能使n(CH3OH)/n(CO2)增大的是________。
| A.升高温度 | B.充入He(g)使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1 mol CO2和3 mol H2 |
②曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“大于”“等于”或“小于”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1 mol CO2、3 mol H2 |
a mol CO2、b mol H2、c mol CH3OH(g)、c mol H2O(g) |
若甲中平衡后气体的压强为开始时的 ,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为________。
(3)用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1的NaOH溶液和20.00 mL 0.10 mol·L-1氨水所得的滴定曲线如下:
请指出盐酸滴定氨水的曲线为________(填“A”或“B”),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序________。
(1)已知:
①Fe(s)+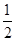 O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
O2(g)=FeO(s) ΔH=-272.0 kJ·mol-1
②2Al(s)+ O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH=-1675.7 kJ·mol-1
Al和FeO发生铝热反应的热化学方程式是____________________________________
(2)某可逆反应在不同条件下的反应历程分别为A、B(如上图所示)。
①根据图判断该反应达到平衡后,其他条件不变,升高温度,反应物的转化率________(填“增大”“减小”或“不变”);
②其中B历程表明此反应采用的条件为________(选填序号)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(3)1000 ℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g) Na2S(s)+4H2O(g)
Na2S(s)+4H2O(g)
该反应的平衡常数表达式为________________________________;
已知K1000 ℃<K1200 ℃,若降低体系温度,混合气体的平均相对分子质量将会________(填“增大”“减小”或“不变”)。
(4)常温下,如果取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1 mol·L-1 NaOH溶液中由水电离出的OH-浓度之比为________;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“<”“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号)________。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其生产流程如下: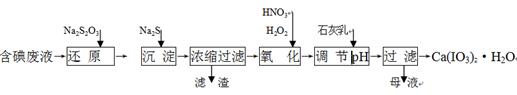
已知:Ca(IO3)2微溶于水,溶于硝酸;Ksp(CuI)=1.1×10-12, Ksp(Cu2S)=2.5×10-48;
氧化性: HNO3>IO3—>H2O2
(1)“还原”过程中主要反应的化学方程式为:2Na2S2O3+I2 = + 2NaI。
(2)在还原过程还伴随有CuI生成,写出加入Na2S的离子反应方程式 。
(3)在氧化过程中先加入H2O2再加入浓硝酸,而不直接加入浓硝酸的目的是 。
(4)加入的石灰乳在溶液中反应而得到Ca(IO3)2,则要调节pH至 (填“酸性” 或“中性”或“碱性”),原因是 。
(5)Ca(IO3)2也可用电化学氧化法制取:先充分电解KI溶液,然后在电解后的溶液中加入CaCl2,最后过滤得到Ca(IO3)2。写出电解时阳极发生的电极反应方程式 ,用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为97.8%Ca(IO3)2的质量为 ____kg(计算结果保留3位有效数字)。
甲醇是一种重要的化工原料。甲醇与水蒸气催化重整可获得清洁能源,具有广泛的应用前景。现有如下实验,在体积为1 L的密闭容器中,充入1mol CH3OH和1molH2O,一定条件下发生反应:CH3OH (g)+ H2O (g) CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
CO2(g) +3 H2 (g),测得CO2和CH3OH(g)的浓度随时间变化如下表所示。
| 时间 物质 |
0 min |
10 min |
30 min |
60 min |
70 min |
| CO2(mol/L) |
0 |
0.2 |
0.6 |
0.8 |
0.8 |
| CH3OH(mol/L) |
1.0 |
0.8 |
0.4 |
0.2 |
0.2 |
①已知:CH3OH (g)+ 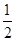 O2 (g)
O2 (g) CO2(g) + 2H2 (g) H1= —192.9kJ/mol
CO2(g) + 2H2 (g) H1= —192.9kJ/mol
H2(g)+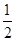 O2 (g)
O2 (g) H2 O(g) H2= —120.9kJ/mol
H2 O(g) H2= —120.9kJ/mol
则甲醇与水蒸气催化重整反应的焓变△H3=_____ 。
②10~30 min内,氢气的平均反应速率v(H2)=___________mol/(L·min)。
③该反应的平衡常数表达式为K=__________________。
④下列措施中能使平衡时n(CH3OH)/n(CO2)减小的是(双选)___________。
A.加入催化剂 B.恒容充入He(g),使体系压强增大
C.将H2(g)从体系中分离 D.再充入1molH2O
(2)甲醇在催化剂条件下可以直接氧化成甲酸。
①在常温下,用0.1000 mol/L NaOH溶液滴定20. 00 mL 0.1000 mol/L 甲酸溶液过程中,当混合液的pH=7时,所消耗的V(NaOH)___(填“<”或“>”或“=”) 20. 00 mL。
②在上述滴定操作中,若将甲酸换成盐酸,请在图中的相应位置画出相应的滴定曲线。(1滴溶液约0.04mL) 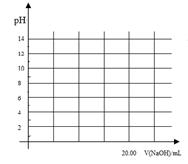
某探究小组将一批电子废弃物简单处理后,得到含Cu、Al、Fe及少量Au、Pt等金属的混合物,并设计如下制备硫酸铜晶体和无水氯化铁的方案:
已知:Cu2+ + 4NH3·H2O=[Cu(NH3)4]2+ + 4H2O
请回答下列问题:
(1)步骤①Cu与酸反应的离子方程式为 。
(2)步骤②加H2O2的作用是 ,滤渣2为(填化学式) 。
(3)步骤⑤不能直接加热脱水的理由是 。
(4)若滤液1中Cu2+的浓度为0.02mol·L-1,则氢氧化铜开始沉淀时的pH =
(已知:Ksp[Cu(OH)2]=2.0×10-20)。
(5)已知:2Cu2++4I-= 2CuI↓+I2 I2+2S2O32-= 2I-+S4O62-
某同学为了测定CuSO4·5H2O产品的质量分数可按如下方法:取3.00g产品,用水溶解后,加入足量的KI溶液,充分反应后过滤、洗涤,将滤液稀释至250mL,取50mL加入淀粉溶液作指示剂,用0.080 mol·L-1 Na2S2O3标准溶液滴定,达到滴定终点的依据是 。
四次平行实验耗去Na2S2O3标准溶液数据如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗Na2S2O3标准溶液(mL) |
25.00 |
25.02 |
26.20 |
24.98 |
此产品中CuSO4·5H2O的质量分数为 。
试题篮
()