实验室中有一未知浓度的稀盐酸,某学生在实验室中进行测定盐酸浓度的实验;请完成下列填空:
(1)配制100mL0.10mol•L-1NaOH标准溶液。
①配制所需的玻璃仪器有:烧杯、量筒、玻璃棒、_______、_______等。
②称取_____g氢氧化钠固体所需仪器有天平(带砝码、镊子)、药匙、______。
(2)取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用_______(填仪器名称)装配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 滴定次数 |
待测盐酸的体积(mL) |
标准NaOH溶液体积 |
|
| 滴定前的刻度(mL) |
滴定后的刻度(mL) |
||
| 第一次 |
20.00 |
0.40 |
20.50 |
| 第二次 |
20.00 |
4.10 |
24.00 |
| 第三次 |
20.00 |
1.00 |
24.00 |
(3)①滴定达到终点的现象是___________________________。
②根据上述数据,可计算出该盐酸的浓度约为_______ mol/L(保留小数点后二位数)。
③给润洗后的滴定管中注入溶液时应________(填序号)
A.借助于漏斗 B.借助于玻璃棒 C.借助于烧杯 D.直接注入
④排去碱式滴定管中气泡的方法应采用下图操作_______ ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
⑤在上述实验中,下列操作(其他操作正确)会造成测定结果偏低的有_______
D.滴定终点读数时俯视读
A.酸式滴定管使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失.
现有下列仪器或用品:①铁架台(含铁圈、各式铁夹) ②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯(若干) ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩过滤漏斗;
下列药品:
| A.NaOH固体 | B.标准NaOH溶液 | C.未知浓度盐酸 | D.蒸馏水(E)碳酸钠溶液 |
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是 (填编号)。
(2)配制250ml一定物质的量浓度的NaOH溶液时,还缺少的仪器是 。
(3)做酸碱中和滴定时,还缺乏的试剂是 。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的 (填编号)。
甲.酸式滴定管 乙.碱式滴定管 丙.25 mL量筒 丁.锥形瓶
(5)某同学用一份已知浓度的盐酸溶液滴定未知浓度的NaOH溶液,下列操作对滴定的结果有什么影响?(填“偏大”、“偏小”或“无影响”)
①酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗。_____________
②滴定前,滴定管尖端有气泡,滴定后气泡消失。_____________
③读酸式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数。_______
④滴定到终点附近时,向锥形瓶中加入少量蒸馏水冲洗瓶壁上沾的溶液_____
下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
(1)仪器A的名称____________;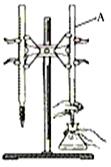
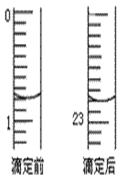
(2) 盐酸的体积读数:滴定前读数为_________mL,滴定后读数为____________ mL;
(3)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的浓度是___________________(保留四位有效数字) ;
| 实验 编号 |
待测NaOH溶液 的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 |
20.00 |
1.20 |
23.22 |
| 2 |
20.00 |
2.21 |
24.21 |
| 3 |
20.00 |
1.50 |
23.48 |
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00 mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是______________________________(用序号字母填写);
(5)判断到达滴定终点的实验现象是_______________________________。
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
① 如果上述B步骤省略,对测定结果的影响是_____________________ ;
②标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是_______________。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)该小组在步骤①中的错误是 ,
由此造成的测定结果 (偏高、偏低或无影响)。
(3)如图,是某次滴定时的滴定管中的液面,其读数为 mL。
(4)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
22.60 |
| 第二次 |
20.00 |
1.00 |
24.50 |
| 第三次 |
20.00 |
2.10 |
24.00 |
请计算待测烧碱溶液的浓度为 。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)下图,是某次滴定时的滴定管中的液面,其读数为 mL
(6)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度(保留四位小数) mol/L
为测定某品牌洗厕精的酸(盐酸)含量,某学生欲用已知物质的量浓度的NaOH溶液来测定该洗厕精(盐酸)的物质的量浓度时,选择酚酞作指示剂。请填写下列空白:
(1)碱式滴定管的使用方法,正确步骤的先后顺序为(填选项符号):
A.用氢氧化钠溶液润洗仪器并加入氢氧化钠溶液
B.放出氢氧化钠溶液进行滴定
C.调节起始读数
D.查漏,再水洗2-3遍
(2)用标准的NaOH溶液滴定待测的盐酸时,左手控制碱式滴定管的玻璃球,右手摇动锥形瓶,眼睛应注视 ;
(3)若滴定开始和结束时,碱式滴定管中的液面如上图所示:则所用NaOH溶液的体积为 mL。
(4)某学生根据三次实验分别记录有关数据如下表:
| 滴定次数 |
待测盐酸的体积/mL |
0.1000 mol/LNaOH溶液的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
2.00 |
28.15 |
26.15 |
| 第二次 |
25.00 |
1.50 |
29.50 |
28.00 |
| 第三次 |
25.00 |
0.20 |
26.55 |
26.35 |
请选用其中合理的数据计算该洗厕精中酸(盐酸)的物质的量浓度:
c(HCl)= 。
(5)分析下列操作对所测洗厕精的酸(盐酸)的浓度的影响:(填“偏大”、“偏小” 或“无影响”)
A.若取待测液时,开始仰视读数, 后俯视读数,则 ;
B.若碱式滴定管在滴定前有气泡,滴定后气泡消失,则 。
草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下列实验。
①称取m g草酸晶体,配成100.0 mL溶液。
②取25.0 mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1 KMnO4溶液滴定。滴定时,所发生反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙和____________、____________、____________。
(2)在实验②中,滴定时KMnO4溶液应装在________式滴定管中,锥形瓶中________
(填“需要”或 “不需要”)滴加指示剂。
(3)在滴定过程中,目光应注视______________________。
(4)若滴定时,滴定前后两次读数分别为amL和bmL,因此计算出x值为________。
(5)若读取读数a时仰视,读取读数b时俯视,则所测x值________(填“偏大”、“偏 小”或“不变”)。
草酸晶体的组成可表示为:H2C2O4·XH2O,为测定X值,进行下列实验:
①称取wg草酸晶体配成100.0mL水溶液;
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为cmol·L-1KMnO4溶定。滴定时,所发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
请回答下列问题:
(1)实验①中为配制准确浓度的草酸溶液,所需用到的仪器是:天平(含砝码)、烧杯、药匙和__________。
(2)实验②中,滴定时,KMnO4溶液应装在 (填“酸式滴定管”、“碱式滴定管”或“移液管”中,原因是_____________________。
(3)判断滴定结束的标准是 __________________________________________ 。
(4)若滴定时,反应前后的两次读数分别为a和b,由此计算出草酸晶体的X值是 。
常温下有浓度为0.1mol/L、体积为VL的氨水,向其中逐滴加入一定浓度的盐酸,得到如图的滴定曲线,其中d点时两种溶液恰好完全反应。根据图像回答下列问题:
(1)上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH如下表,请将表格补充完整:
| 离子浓度大小顺序 |
溶质化学式 |
溶液的pH |
| c (NH4+)>c (OH-)>c (CI-)>c (H+) |
① |
>7 |
| ② |
③ |
=7 |
| ④ |
NH4Cl |
⑤ |
(2)该温度时氨水的电离平衡常数K数值约为____________。滴定过程中所用盐酸的pH=____________。
(3)若取该实验中恰好完全反应的d点溶液,向其中滴加0.1VL某浓度的氨水后溶液呈中性,依(2)中计算结果计算所滴加氨水的浓度为____________ moI/L。
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:
(1)配制100mL待测白醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到___________(填仪器名称)中定容,摇匀即得。
(2)用 取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴 作指示剂。
(3)读取盛装0.1000 mol/L NaOH 溶液的 (填仪器名称)的初始读数。如果液面位置如图所示,则此时的读数为 mL。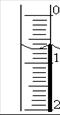
(4)滴定。当 时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
| 滴定次数 实验数据(mL) |
1 |
2 |
3 |
4 |
| V(样品) |
20.00 |
20.00 |
20.00 |
20.00 |
| V(NaOH)(消耗) |
15.95 |
15.00 |
15.05 |
14.95 |
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量= g/100mL。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是 (填写序号)。
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| |
NaOH起始读数 |
NaOH终点读数 |
| 第一次 |
0.10mL |
18.60mL |
| 第二次 |
0.30mL |
18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
| 实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1HCl溶液的体积/mL |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 1 |
25.00 |
0.00 |
26.29 |
| 2 |
25.00 |
1.56 |
31.30 |
| 3 |
25.00 |
1.00 |
27.31 |
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后 再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
| |
NaOH起始读数 |
NaOH终点读数 |
| 第一次 |
0.10mL |
18.60mL |
| 第二次 |
0.30mL |
18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为 mol·L-1.
(2)达到滴定终点的标志是
(3)以下操作造成测定结果偏高的原因可能是 。
A. 配制标准溶液的氢氧化钠中混有Na2CO3杂质
B. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E. 未用标准液润洗碱式滴定管
(10分)已知草酸晶体( )可溶于水,并可与酸性高锰酸钾溶液完全反应:
)可溶于水,并可与酸性高锰酸钾溶液完全反应:
现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol·L-1的KMnO4标准溶液进行滴定,三次结果如下:
| |
第一次滴定 |
第二次滴定 |
第三次滴定 |
| 待测溶液体积(mL) |
25.00 |
25.00 |
25.00 |
| 标准溶液体积(mL) |
9.99 |
10.01 |
10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在 (填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是 (填序号)。
①100mL容量瓶 ②烧杯 ③滴定管夹 ④漏斗 ⑤玻璃棒 ⑥托盘天平
(3)到达滴定终点的标志是 。
(4)根据上述数据计算X= 。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值 ;
②若KMnO4标准溶液浓度偏低,则X值 。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_________
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是___________________________
(5)如图,是某次滴定时的滴定管中的液面,其读数为 mL

(6)
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前度数(mL) |
滴定后度数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度 mol/L.
试题篮
()