下列说法正确的是( )
| A.泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里。 |
B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14 |
| D.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
下列操作中,能使水的电离平衡向右移动,而且所得溶液显酸性的是( )
| A.对水加热到100℃,测得PH=6 | B.在水中滴入稀硫酸 |
| C.在水中加入小苏打 | D.在水中加入氯化铝固体 |
25℃时,0.1mol/L HCl中,下列说法正确的是( )
| A.c(H+)×c(OH-)=1×10-14 | B.该溶液中由水电离出的c(H+)= 1×10-7 |
| C.c(H+)=c(OH-)=1×10-7 | D.c(H+)×c(OH-)=1 |
向10mL一定物质的量浓度的盐酸中滴加一定物质的量浓度的NaOH溶液,其pH变化如右图所示,则两溶液的物质的量浓度分别是( )

| |
A |
B |
C |
D |
| 盐酸的物质的量浓度mol/L |
0.12 |
0.04[来 |
0.03 |
0.09 |
| NaOH的物质的量浓度mol/L |
0.04 |
0.12 |
0.09 |
0.03 |
某温度下,水的离子积约为10-12,将Va L pH=2的硫酸溶液与Vb L pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va∶Vb为( )
| A.2∶11 | B.11∶2 | C.9∶2 | D.2∶9 |
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:
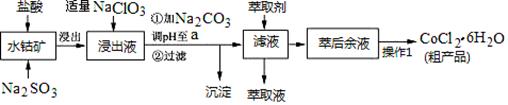
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式________________________。
(2)写出NaClO3发生反应的主要离子方程式____________________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_________________________。
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是_____________________。(答一条即可)
下列各表述与示意图一致的是( )

| A.图①表示25℃时,用0.1 mol/L盐酸滴定20 mL 0.1 mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 |
B.图②表示一定条件下进行的反应2SO2(g) + O2(g) 2SO3(g) ΔH < 0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 2SO3(g) ΔH < 0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 |
| C.图③表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH溶液体积的关系,在加入20 mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
| D.图④表示化学反应H2(g)+C12(g)==2HCl(g)的能量变化,则该反应的反应热△H=﹢183 kJ/mol |
室温下,将0.100 0 mol·L-1盐酸滴入20.00 mL 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如右图所示。下列有关说法不正确的是( )

| A.该一元碱溶液浓度为0.100 0 mol·L-1 |
| B.a、b、c点的水溶液导电性依次增强 |
| C.室温下,MOH的电离常数Kb=1×10-5 |
| D.b点:c(M+)+c(MOH)=c(Clˉ) |
常温下,向20 mL xmol·L-1CH3COOH溶液中逐滴加入等物质的量浓度的NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如下图所示(忽略温度变化)。下列说法中正确的是
| A.图中V1 >20 mL |
| B.上述CH3COOH溶液中:c(H+〉>1×10-3 mol·L-1 |
| C.a点对应的溶液中:c (CH3COO-)=c (Na+) |
| D.当加入NaOH溶液的体积为20 mL时,溶液中:c (CH3COOH) + c (H+)>c (OH-) |
草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钻矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4.2H2O工艺流程如下:

己知:,①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 完全沉淀的pH |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
(1)浸出过程中加入Na2SO3的目的是 。
(2)将氯气通入到热的浓氢氧化钠溶液可以来制取NaClO3,请写出该反应的离子方程式为______________;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为____ .(标准状况下)。
(3)萃取剂对金属离子的萃取率与pH的关系 ,如图所示。滤液II中加入萃取剂的作用是 ;使用萃取剂最适宜的pH是 (填选项序号)。

A.接近2.0
B.接近3.0
C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-1。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=________
(5)为测定制得的无水草酸钴样品的纯度,现称取样品mg,先用适当试剂将其转化,得到纯净的草酸铵溶液,再用过量的稀硫酸酸化,用c mol/L高锰酸钾溶液去滴定,当溶液由 时(填颜色变化),共用去高锰酸钾溶液V mL,计算草酸钴样品的纯度为 。
(6)浓度均为0.l mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为
已知:H2SO3 Ka1=1.54×10-2 Ka2=1.02×10-7
H2CO3 Ka1=4.3×10-7 Ka2=5.6×10-11
在一定条件下,0.2 mol下列气体分别与1 L 0.2 mol.L一1的NaOH溶液反应,形成的溶液pH最小的是
| A.SO3 | B.SO2 | C.NO2 | D.CO2 |
室温下,下列有关两种溶液的说法不正确的是
| 序号 |
① |
② |
| pH |
12 |
12 |
| 溶液 |
氨水 |
氢氧化钠溶液 |
A.①②两溶液中c(OH-)相等
B.①溶液的物质的量浓度为0.01mol·L-1
C.①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>②
D.等体积的①②两溶液分别与0.01 mol·L-1的盐酸完全中和,消耗盐酸的体积:①>②
关于常温下0.1 mol/L氨水(pH=11.12)的下列说法不正确的是
| A.加水稀释过程中,c(H+)/c(OH-) 的值增大 |
| B.根据以上信息,可推断NH3·H2O为弱电解质 |
C.与pH=11.12的 NaOH溶液相比,NaOH溶液中c(Na+) 大于氨水中c(NH ) ) |
| D.加入少量NH4Cl 固体,溶液中水的电离平衡:H2O ⇌H+ + OH-正向移动 |
常温下,若HA溶液和NaOH溶液混合后pH =7,下列说法不合理的是
| A.反应后HA溶液可能有剩余 |
| B.生成物NaA的水溶液的pH可能小于7 |
| C.HA溶液和NaOH溶液的体积可能不相等 |
| D.HA溶液的c(H+)和NaOH溶液的c(OH -)可能不相等 |
试题篮
()