某无色溶液中只可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
(1)用pH试纸测得溶液的pH大于7
(2)向溶液中滴加氯水,再加入CCl4振荡,静置后,CCl4层呈橙色
(3)向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀产生
(4)过滤,向滤液中加入AgNO3溶液和稀HNO3有白色沉淀产生
下列结论正确的是
| A.肯定含有的离子是③④⑤ | B.肯定没有的离子是②⑤ |
| C.可能含有的离子是①⑥ | D.不能确定的离子是③⑥ |
下列有关说法正确的是
| A.催化剂可以加快化学反应速率,也能增大化学反应的焓变 |
| B.常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 |
C.25 ℃下,在NH3·H2O稀溶液中加水稀释, 的值不变 的值不变 |
| D.在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-电离程度减小 |
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+ H2O  H2SO3 + OH- ①
H2SO3 + OH- ①
HSO3- H+ + SO32- ②
H+ + SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
| A.加入少量固体NaOH,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 |
| B.加入等体积等浓度Na2SO3溶液,则3c(Na+) = 2[c(HSO3-) + c(H2SO3) +c(SO32-)] |
C.加入少量NaOH溶液, 、 、 的值均增大 的值均增大 |
| D.加入氨水至中性,则2c(Na+) = c(SO32-)>c(H+) = c(OH-) |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度则 =2时,若两溶液同时升高温度则 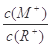 增大 增大 |
已知某温度下CH3COOH和NH3•H2O 的电离常数相等,现向10mL浓度为0.1mol•L‾1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
| A.水的电离程度始终增大 |
| B.c(NH4+)/c(NH3•H2O)先增大再减小 |
| C.c(CH3COOH)与c(CH3COO‾)之和始终保持不变 |
| D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO‾) |
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是
A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)= c(A—)+ c(HA)
D.b点所示溶液中c(A—)> c(HA)
对于常温下pH为1的硝酸溶液,下列叙述正确的是
| A.该溶液1 mL稀释至100 mL后,pH等于3 |
| B.向该溶液中加入pH为13的氢氧化钡溶液恰好完全中和 |
| C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12 |
| D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍 |
下列反应水解方程式正确的是
| A.AlCl3+3H2O=Al(OH)3+3HCl |
B.Na2CO3+2H2O H2CO3+2NaOH H2CO3+2NaOH |
C.碳酸氢钠溶液:HCO3-+H2O H2CO3+OH— H2CO3+OH— |
D.NH4Cl溶于D2O中:NH4++D2O NH3·D2O+H+ NH3·D2O+H+ |
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是
| A.溶质的电离方程式为NaHCO3=Na++ H++ CO32 - |
| B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大 |
| C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3- )+c(CO32 -) |
| D.温度升高,c(HCO3- )增大 |
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是

| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度,则 =2时,若两溶液同时升高温度,则  增大 增大 |
水的电离平衡为H2O H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
| A.将水加热,pH减小 |
| B.恒温下,向水中加入少量固体KOH,Kw不变 |
| C.向水中滴入稀醋酸,c(H+)增大 |
| D.向水中加入少量固体NaClO,平衡逆向移动 |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.在稀硫酸中加入少量氢氧化钠固体,溶液导电性增强 |
| B.饱和碳酸钠溶液中:c(Na+)=2c(CO32-) |
| C.饱和食盐水中:c(Na+) + c(OH-)c(Cl-)+ c(H+) |
| D.pH=12的NaOH溶液中:c(OH-)=1.0×10-2 mol·L-1 |
25℃时,在10mL浓度均为0.1mol/L的NaOH和NH3•H2O混合溶液中滴加0.1mol•L﹣1盐酸,下列有关溶液中粒子浓度关系正确的是
| A.未加盐酸时:c(OH﹣)>c(Na+)=c(NH3•H2O) |
| B.加入10mL盐酸时:c(NH4+)+c(H+)=c(OH﹣) |
| C.加入盐酸至溶液pH=7时:c(Cl﹣)=c(Na+) |
| D.加入20mL盐酸时:c(Cl﹣)=c(NH4+)+c(Na+) |
下列说法正确的是
A.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的熵增
B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
C.常温下Ksp(Ag2CrO4)=1.1×10-12,Ksp(AgCl)=1.8×10-10,则Ag2CrO4的溶解度小于AgCl
D.等体积、物质的量浓度的HA与NaA(HA为弱酸)混合溶液,其酸碱性取决于Ka(HA)的大小
某无色稀溶液X中,可能含有如表所列离子中的某几种。
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示 下列说法正确的是
下列说法正确的是
A.若Y是盐酸,则X中一定含有CO32-、SiO32-、AlO2-和Na+
B.若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl-
C.若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-=NH3↑+H2O
D.若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+物质的量之比为1:1:2
试题篮
()