下列溶液中微粒浓度关系一定正确的是( )
| A.均为0.10mol·L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者小于后者 |
| B.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
| C.25℃时pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 |
| D.25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH< 7 |
下列溶液中微粒浓度关系一定正确的是( )
| A.均为0.10mol·L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者小于后者 |
| B.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW |
| C.25℃时pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者 |
| D.25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH< 7 |
常温下,下列溶液中,有关微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液: c(NH )> c(SO )> c(SO )>c(Fe2+)>c(H+) )>c(Fe2+)>c(H+) |
B.0.1 mol·L-1 Na2CO3溶液:c(Na+)+c(H+)=c(CO )+c(HCO )+c(HCO )+c(OH-) )+c(OH-) |
C.0.1 mol·L-1 NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH-)+c(CO ) ) |
| D.0.01 mol·L-1NaOH溶液与等体积pH=2的醋酸混合后的溶液中: |
c (CH3COO-) > c (Na+) > c (H+)> c (OH-)
下列溶液中各微粒的浓度关系正确的是
A.室温下,pH=7的醋酸和醋酸钠的混合溶液中:c(CH3COO-)>c(Na+)
B.将10 mL 0.l mol·L-1 Na2CO3溶液逐滴滴加到10 mL 0.l mol·L-1盐酸中:
c(Na+) >c(Cl-) >c(HCO3-) >c(CO32-)
C.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+) = c(K+) = c(Ba2+)
D.0.2 mol·L-1的某一元弱酸HA溶液和0.l mol·L-1NaOH溶液等体积混合后的溶液:
2c(OH-) + c(A-) = 2c(H+) + c(HA)
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
(1)加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是 发生反应的离子方程式为
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的最佳试剂为 。
A.溴水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(1)蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体(分子式为CH4·9H2O),则356g“可燃冰”释放出的甲烷燃烧,生成液态水时能放出1780.6 kJ的热量,则甲烷燃烧的热化学方程式可表示为:_______________________________。
(2) 在100℃时,将0.100mol的N2O4气体充入1 L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到下表数据: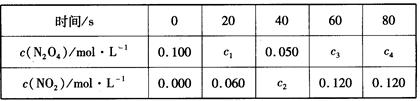
①从表中分析:该反应的平衡常数为___________;
②在上述条件下,60s内N2O4的平均反应速率为_____________;
③达平衡后下列条件的改变可使NO2浓度增大的是_________。
| A.增大容器的容积 | B.再充入一定量的N2O4 |
| C.再充入一定量的NO2 | D.再充入一定量的He |
(3)常温下①用等浓度的盐酸分别中和等体积pH=12的氨水和NaOH溶液,消耗盐酸的体积分别为V1、V2,则V1_____V2(填“>”“<”或“=”下同);
②用等浓度的盐酸分别中和等体积浓度均为0.01mol/L的氨水和NaOH溶液,消耗盐酸的体积分别为V3、V4,则V3_____V4;
③用等浓度的盐酸分别和等体积浓度均为0.01mol/L的氨水和NaOH溶液反应,最后溶液均为中性,消耗盐酸的体积分别为V5、V6,则V5_____V6。
下列溶液中离子浓度关系的表示正确的是( )
A.NaHCO3溶液中:c(H+)+c(Na+)=c(OH-)+c(CO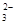 )+c(HCO )+c(HCO ) ) |
| B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后的溶液中:c(OH-)>c(H+)+c(CH3COO-) |
C.0.1 mol·L-1的NH4Cl溶液中:c(Cl-)>c(H+)>c(NH )>c(OH-) )>c(OH-) |
| D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中: |
2c(Na+)=c(CH3COOH)+c(CH3COO-)
下列溶液中有关物质的量浓度关系正确的是( )
A.0.1 mol/L pH=3的H2A溶液与0.01 mol/L pH=11的MOH溶液任意比混合:
c(H+)+c(M+)=c(OH-)+2c(A2-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:
c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
已知常温下KHSO3溶液的pH<7,且等浓度的HSO3-的电离程度大于SO32-的水解程度。等物质的量的KHSO3、K2SO3、K2SO4溶于足量水形成的溶液中,有关粒子之间的关系正确的是
| A.c(SO42-)>c(HSO3-)>c(SO32-) >c(H2SO3) |
| B.c(K+)>c(SO32-)>c(SO42-)>c(HSO3-)>c(H+)>c(OH-) |
| C.c(K+)=c(HSO3-)+2c(SO32-)+2c(SO42-) |
| D.c(K+)+c(H+)=c(HSO3-)+c(SO32-)+c(SO42-)+c(OH-) |
下列有关说法正确的是( )
| A.常温下,0.1 mol·L—1Na2S溶液中存在:c(OH—)=c(H+) + c(HS—) + c(H2S) |
| B.常温下,0.1 mol·L—1HA溶液与0.1 mol·L—1 NaOH溶液正好完全反应时,溶液中一定存在:c(Na+)=c(A—)>c(OH—)=c(H+) |
| C.常温下,向0.1 mol·L—1CH3COOH 溶液加水稀释,当溶液的pH从3.0升到4.0时, 溶液中  的值增大到原来的10倍 的值增大到原来的10倍 |
| D.常温下,pH=7的CH3COONa和CH3COOH混合溶液中: |
c(Na+)=c(CH3COOH)>c(CH3COO—)>c(H+)=c(OH—)
下列说法正确的是
A.某温度时, 1LpH=6的水溶液,含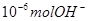 离子 离子 |
B.含10.6gNa2CO3溶液中,所含阴离子总数等于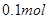 |
| C.VLamol/LFeCl3溶液中,若Fe3+离子数目为1mol,则Cl-离子数目大于3mol。 |
D.电解精炼粗铜时,每转移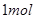 电子,阳极上溶解的 电子,阳极上溶解的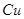 原子数必为 原子数必为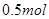 |
将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度关系正确的是
| A.c(NH4+)>c(Cl–)>c(H+)>c(OH–) | B.c(NH4+)>c(Cl–)>c(OH–)>c(H+) |
| C.c(Cl–)>c(NH4+)>c(H+)>c(OH–) | D.c(Cl–)>c(NH4+)>c(OH–)>c(H+) |
下表是不同温度下水的离子积常数:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
KW |
1×10-12 |
试回答以下问题:
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是 。
(2)25℃ 下,将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,则V1 : V2=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”、 “中”或“碱”),溶液中c(Na+) c(CH3COO-)[填“>”、“=”或“<”] 。
下列各溶液中,相关微粒物质的量浓度关系不正确的是
| A.0.1 mol·L-1NaHCO3溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-) |
| B.0.1 mol·L-1NH4Cl溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)=0.1 mol·L-1 |
| C.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| D.常温下,浓度为0.1 mol·L-1 NaHSO3溶液的pH<7:c(Na+)>c(HSO3-)>c(SO32-)> c(H+) |
(15分)海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,
最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式
Ksp= 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有
a.MgO b.Mg(OH)2 c.MgCO3 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出相关的化学方程式之一
。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是 。
(6)电解熔融的MgCl2,阳极的电极反应式为: ;阴极的电极反应式为 。
试题篮
()