草酸是二元弱酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol NaHC2O4溶液中滴加0.01 mol
NaHC2O4溶液中滴加0.01 mol NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,KW不变 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.在Na2S稀溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1 |
| D.0.1mol/LNaOH溶液和0.2mol/LCH3COOH溶液等体积混合: |
c(CH3COO-)> c(Na+)> c(CH3COOH)> c(H+)> c(OH-)
(Ⅰ)有一无色溶液,其中可能含有Fe3+、Al3+、Fe2+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-离子的几种,取此溶液分别进行了四个实验,其操作和有关现象如下图所示:
请根据上图推断:
(1)原溶液中一定存在的离子有 。
(2)写出实验④中沉淀量由A→B过程中所发生反应的离子方程式: 。
(3)实验③中产生无色无味气体所发生的化学方程式为: 。
(Ⅱ)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(4)该反应中,化合价升高的反应物是 。
(5)上述反应中,1 mol氧化剂在反应中得到电子的数目为 mol。
四种易溶于水的强电解质A、B、C、D由以下7种离子组成(电解质中阴离子各不相同)。
| 阳离子 |
Na+、 Ba2+、 NH4+ |
| 阴离子 |
CH3COO-、Cl-、OH-、SO42- |
已知:①A、C溶液显碱性,B溶液显酸性;②B和C的溶液混合反应的现象只是有刺激性气味的气体生成,C和D的溶液混合反应的现象只是有白色沉淀生成,A和D的溶液混合无明显现象。
(1)A是___ _,B是__ __。
(2)A溶液显碱性的离子方程式_____ ___。
(3) C与D的溶液反应的离子方程式_____ ___。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合反应后溶液中各种离子浓度由大到小的顺序是
____ ___。
(5)向用盐酸中和后的C溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br—)/c(Cl—)=_________。(已知Ksp(AgCl) =2.0×10-10,Ksp(AgBr) =5.4×10-13)
(6)25℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中c(H+)—c(NH3·H2O)= (用含有a的关系式表示)。
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是
| A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH) |
(1)已知:蒸发1 mol Br2(l)需要吸收的能量为 30 kJ,其他相关数据如下表:
| 物质 |
H2(g) |
Br2(g) |
HBr(g) |
| 1 mol分子中化学键断裂时需要吸收的能量/kJ |
436 |
200 |
369 |
H2(g)+Br2(l)=2HBr(g) ΔH= 。
(2)常温下,将pH均为2的氢溴酸、乳酸(α—羟基丙酸)稀释100倍后,有一种酸的pH=4。请写出乳酸钠溶液中的水解离子方程式: 。
(3)常温下,用0.100 0 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HBr溶液和20.00 mL0.100 0 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如图所示:
①根据图1和图2判断,滴定HBr溶液的曲线是 (填“图1”或“图2”);
②a= mL;
③c(Na+)=c(CH3COO-)的点是 点;
④E点对应溶液中离子浓度由大到小的顺序为 。
钠及其化合物具有广泛的用途。
(1)工业上制备金属钠的常用方法是 (用离子方程式表示)。
(2)用Na2CO3熔融盐作电解质,CO、O2、CO2为原料可组成新型电池。该电池的结构如图所示: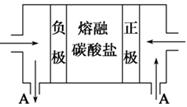
正极的电极反应式为 ,电池工作时物质A可循环使用,A物质的化学式为 。
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表:
| 溶质 |
CH3COONa |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
11.6 |
10.3 |
11.1 |
上述盐溶液的阴离子中,结合H+能力最强的是 ,根据表中数据,浓度均为0.01 mol·L-1下列四种酸的溶液分别稀释100倍,pH变化最大的是 (填序号)。
a.HCN b.HClO c.CH3COOH d.H2CO3
(4)实验室中常用NaOH来进行尾气处理、洗气和提纯。
①常温下,当300 mL 1 mol·L-1的NaOH溶液吸收4.48 L(折算成标准状况)SO2时,所得溶液pH>7,则溶液中各离子浓度由大到小的顺序为 。
②已知几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加某浓度的NaOH溶液时, (填离子符号)先沉淀,Ksp[Fe(OH)2] Ksp[Mg(OH)2](填“>”、“=”或“<”)。
在55℃时,下列说法正确的是
| A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变 |
| B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L |
| C.饱和氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) |
| D.0.1mol/L的(NH4)2SO4溶液中:c(NH4+) > c(SO42-) > c(H+) > c(OH-) |
已知草酸为二元中强酸,具有较强还原性,草酸氢钠(NaHC2O4)水溶液呈酸性,下列说法正确的是
| A.草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+)=c(HC2O4-)+ c(C2O42-) |
| B.NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-=HClO+C2O42- |
| C.草酸氢钠溶液中:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)> c(OH-) |
| D.草酸使酸性KMnO4溶液褪色,其离子方程式为:5C2O42-+ 2MnO4-+16H+= 2Mn2++ l0CO2↑+8H2O |
室温下将等物质的量的NaCN和HCN溶于一定量水中,再加入适量稀盐酸,调整溶液pH=7。下列说法正确的是( )
| A.未加入稀盐酸之前:c(HCN)>c(Na+)>c( CN-) >c(OH-)>c(H+) |
| B.加稀盐酸后溶液中c(CN-)+c(HCN)= c(Na+) |
| C.pH=7时,溶液中:c( Na+)=" c(" CN-) |
| D.加稀盐酸后H2O的电离程度减小 |
(本题共16分)硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下: 
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡
回答下列问题:
(1)锡元素原子的核电荷数为50,与碳元素属于同一主族,锡元素在周期表中的位置是 。
(2)操作Ⅰ是 。
(3)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 __________。
(4)加入Sn粉的作用有两个:①调节溶液pH ② ______________________。
(5)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是 _____________。
(6)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(7)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl===SnCl2 + H2↑;
②加入过量的FeCl3溶液;
③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl ===6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1.226 g锡粉,经上述各步反应后,共用去0.100 mol/L K2Cr2O7溶液32.0 mL。锡粉中锡的质量分数是 。
下列关于溶液中离子的说法正确的是
| A.0.1 mol·L-1的Na2CO3溶液中离子浓度关系:c (Na+)="2c" (CO32-)+c (HCO3-)+c (H2CO3) |
| B.0.1 mol·L-1的NH4Cl和0.1 mol·L-1的NH3·H2O等体积混合后溶液中的离子浓度关系: c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| C.常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中,离子浓度关系: c(Na+)=c(CH3COO-) |
| D.0.1 mol·L-1的NaHS溶液中离子浓度关系:c (OH-)="c" (H+)-c (S2-)+c (H2S) |
(本题16分)降低大气中CO2的含量和有效地开发利用CO2正成为研究的主要课题。
(1)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH =-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH =-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH =-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:______________________。
(2)在容积为2L的密闭容器中,充入2mol CO2和6mol H2,在温度500℃时发生反应:
CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) △H<0。
CH3OH(g)+ H2O(g) △H<0。
CH3OH的浓度随时间变化如图。回答有关问题:
①从反应开始到20分钟时,H2的平均反应速率v(H2)=_________________
②从30分钟到35分钟达到新的平衡,改变的条件可能是__________________________
A.增大压强 B.加入催化剂 C.升高温度 D.增大反应物的浓度
③列式计算该反应在35分钟达到新平衡时的平衡常数(保留2位小数)
④如果在30分钟时,再向容器中充入2mol CO2和6mol H2,保持温度不变,达到新平衡时,CH3OH的浓度____________1mol.L-1(填“>”、“<”或“=”)。
(3)一种原电池的工作原理为:2Na2S2 + NaBr3  Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
Na2S4 + 3NaBr。用该电池为电源,以氢氧化钾水溶液作电解质进行电解,使CO2在铜电极上可转化为甲烷。
①该电池负极的电极反应式为:______________________________________
②电解池中产生CH4一极的电极反应式为: ____________________________________。
(4)下图是NaOH吸收CO2后某种产物的水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数。
下列叙述正确的是 _____________
A.此图是1.0 mol·L-1碳酸钠溶液滴定1.0 mol·L-1 HCl溶液的滴定曲线
B.在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-)
C.人体血液的pH约为7.4,则CO2在血液中多以HCO3-形式存在
D.若用CO2和NaOH反应制取NaHCO3,宜控制溶液的pH为7~9之间
一定温度下,下列溶液的离子浓度关系式正确的是
| A. |
|
| B. |
|
| C. |
|
| D. |
|
试题篮
()