常温下,用 0.1000 mol·L NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L
 溶液所得滴定曲线如图。下列说法正确的是
溶液所得滴定曲线如图。下列说法正确的是
A.点①所示溶液中: |
B.点②所示溶液中: |
C.点③所示溶液中: |
| D.滴定过程中可能出现: |

实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是( )
| A.防止硫酸铁分解 | B.抑制硫酸铁水解 |
| C.提高硫酸铁的溶解度 | D.提高溶液的pH值 |
广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述信息,下列说法不正确的是( )
A. 的水解产物是 的水解产物是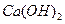 和 和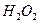 |
B.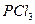 的水解产物是 的水解产物是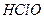 和 和 |
C.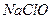 的水解产物之一是 的水解产物之一是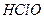 |
D.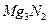 的水解产物是两种碱性物质 的水解产物是两种碱性物质 |
下列叙述正确的是
A.pH为3的盐酸中,其 是pH为1的盐酸中的3倍 是pH为1的盐酸中的3倍 |
B. 溶液和 溶液和 氨水中,其 氨水中,其 相等 相等 |
C.在25℃时,无论是酸性、碱性还是中性溶液中,其 和 和 的乘积都等于 的乘积都等于 |
D. 溶液加水稀释后,恢复至原温度,pH和Kw均减小 溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
下列关于溶液中离子的说法正确的是
A.0.1mol·L-1的Na2CO3溶液中离子浓度关系:c(Na+)=2 c(CO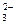 )+ c(HCO )+ c(HCO )+ c(H2CO3) )+ c(H2CO3) |
| B.0.1mol·L-1的NH4Cl和0.1mol·L-1的NH3·H2O等体积混合后溶液中的离子浓度关系: c(Cl-)> c(NH  )> c(OH-)> c(H+) )> c(OH-)> c(H+) |
| C.常温下,醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中,离子浓度关系: c(Na+)< c(CH3COO-) |
| D.等物质的量浓度、等体积的NH4NO3和KNO3溶液中,前者的阳离子浓度小于后者的阳离子浓度 |
下列各组数据关系中,前者比后者大的是( )
| A.常温常压下,pH =10的KOH溶液和pH=" 10" 的CH3COOK溶液中,由水电离的OH -浓度 |
| B.纯水在100 0C和20℃时pH |
| C.25℃,浓度相同的硅酸钠溶液与碳酸钠溶液的pH |
| D.l0mL mol·L-1醋酸溶液稀释10倍,稀释前后的H+数目 |
下列叙述正确的是( )
A.0.1mol·L-1氨水中,c(OH-)=c(NH4+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.在0.1mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)+c(CH3COO-)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
(平行班做)常温下,把pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系正确的是( )
| A.c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C.c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
(实验班做)在一定的温度下,向CH3COONa的稀溶液里加水稀释,下列各种量的变化中,变大的是( )
①c(H+)的物质的量浓度 ②c(OH-)的物质的量浓度
③c (CH3COO-)/c(CH3COOH) ④水的浓度⑤c(H+)·c(OH-)
| A.①④ | B.① | C.③④ | D.②⑤ |
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液以等体积混和,则混合液中微粒浓度关系正确的为 ( )
| A.c (CH3COO-)>c (Na+) | B.c (OH-)>c (H+) |
| C.c (CH3COOH)>c (CH3COO-) | D.c (CH3COOH)+c (CH3COO-)=0.02mol/L |
(实验班做)室温下,下列溶液等体积混合后,所得溶液的pH一定大于7的是
A 0.1mol/L的盐酸和0.1mol/L的氢氧化钠溶液
B.0.2 mol/L的盐酸和0.1mol/L的氢氧化钡溶液
C.pH=4的醋酸溶液和pH=10的氢氧化钠溶液
D.pH=4的盐酸和pH=l0的氨水
下列固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是( )
①胆矾 ②氯化铝 ③硫酸铝 ④Na2CO3⑤NaHCO3⑥高锰酸钾
| A.③④ | B.①③④ | C.①②③④⑤ | D.全部 |
试题篮
()