泡沫灭火器中试剂包括Al2(SO4)3溶液(约1mol·L-1)、NaHCO3溶液(约1mol·L-1)及起泡剂。使用时发生反应的化学方程式为_______________________________________,Al2(SO4)3溶液与NaHCO3溶液的体积比为__________。若用等体积、等物质的量浓度的Na2CO3代替NaHCO3溶液,在使用时喷不出泡沫,这是因为_____________;若用固体NaHCO3代替NaHCO3溶液,在使用时也喷不出泡沫,这是因为______________________________。泡沫灭火器内的玻璃筒里盛硫酸铝溶液,铁筒里盛碳酸氢钠溶液,不能把硫酸铝溶液盛放在铁筒里的原因是________________________________________________________________。
浓度均为0.1mol·L-1的8种溶液:①HNO3②H2SO4③HCOOH④Ba(OH)2⑤NaOH⑥CH3COONa⑦KCl⑧NH4Cl,其溶液的pH由小到大的顺序是(填写编号)______________________。
已知NaHCO3溶液呈弱碱性,则:
(1)溶液中各离子浓度大小顺序为_________________。
(2)由物料守恒可得c(Na+)=______________________。
(3)由电荷守恒可得c(Na+)+_________=________________。
Na2SO3和NaClO两种钠盐分别溶于水后,溶液的pH均大于7,露置于空气中相当一段时间后(不考虑水分挥发)溶液pH都近似为7。这两种溶液呈碱性的原因分别是:_______________________、________________________(用离子方程式表示)。久置呈中性的原因是_____________________________________________________________________。
某盐的化学式XmYn为最简结构(m≠n),将一定量的盐溶于足量水时:
(1)若测得溶液的pH为5,则该盐与水反应的离子方程式可能为:__________________。
(2)若测得该盐溶液的pH为9,则该盐与水反应的离子方程式可能为:_______________。
(3)若X、Y为同周期的短周期元素,XmYn溶于水时,有白色沉淀产生,又有无色气体放出,则XmYn溶于水的化学方程式为:______________________________。
已知某溶液中只存在OH-、H+、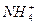 、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Cl-四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(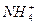 )>c(H+)>c(OH-)②c(Cl-)>c(
)>c(H+)>c(OH-)②c(Cl-)>c(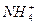 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
③c(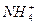 )>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(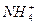 )>c(OH-)
)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶液是_______________,上述四种离子的浓度的大小顺序为_______________(填序号)。
(2)若上述关系中③是正确的,则溶液中的溶质为_______________;若上述关系中④是正确的,则溶液中的溶质是_______________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好成中性,则混合前c(HCl)_________c(NH3·H2O)(填“大小”“小于”或“等于”)。
某同学想把AlCl3溶液和Na2S溶液混合制取Al2S3,但最后得到一种白色絮状沉淀,并且混合液中有臭鸡蛋气味的气体放出。试解释造成此结果的原因,写出反应的离子方程式,并指出制取硫化铝的正确方法。
(1)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有
①____________________________________________________________________________;
②____________________________________________________________________________。
用离子方程式表示产生上述现象的原因___________________________________________
____________________________________________________________________________。
(2)在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是________。
| A.磷 | B.硫 | C.镁 | D.铜 |
(3)向物质的量之和为0.1mol的FeCl3、AlCl3的混合溶液中加入90mL4mol·L-1的NaOH溶液,使其充分反应。假设原溶液中Al3+物质的量与Fe3+和Al3+总物质的量之比为x。
①当x=0.4时,溶液中产生的沉淀是_____________,其物质的量为_____________。
②当沉淀只有Fe(OH)3时,x的取值范围为_____________。
在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,观察到的现象是:_____________________。其原因是(以离子方程式和简要文字说明):__________。
(1)现有0.1mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,正确的操作是__________。纯碱溶液呈碱性的原因(用离子方程式表式)是__________,你认为该溶液pH的范围一定介于__________之间。
(2)为探究纯碱溶液呈碱性是由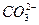 引起的,请设计一个简单的实验方案。
引起的,请设计一个简单的实验方案。
某温度下0.1mol·L-1Na2CO3溶液中,c(Na+)/c( )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c( )=5/2>20/9,其原因是_________,此时c(
)=5/2>20/9,其原因是_________,此时c(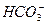 )=_________。
)=_________。
现有电解质溶液:①Na2CO3②NaHCO3
③NaAlO2④CH3COONa⑤NaOH。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是__________(填编号)。
(2)将上述物质的量浓度均为0.1mol·L-1的五种溶液,稀释相同倍数时,pH变化最大的是__________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是__________(填编号)。
(4)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为__________。
(1)现有0.1 mol·L-1的纯碱溶液,试用pH试纸测定溶液的pH,其正确的操作是___________________;纯碱溶液呈碱性的原因是_________________(用离子方程式表示)。
(2)为探究纯碱溶液呈碱性是由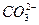 引起的,请你设计—个简单的实验方案:___________。
引起的,请你设计—个简单的实验方案:___________。
(3)为证明盐的水解是吸热反应,四位学生分别设计如下方案,其中正确的是( )
| A.甲学生:在醋酸钠溶液中滴入2滴酚酞,加热后红色加深,说明盐类水解是吸热反应 |
| B.乙学生:在盐酸中加入氨水,混合液温度上升,说明盐类水解是吸热反应 |
| C.丙学生:将硝酸铵晶体溶于水,水温下降,说明盐类水解是吸热反应 |
| D.丁学生:在氨水中加入氯化铵固体,溶液的pH变小,说明盐类水解是吸热反应 |
常温下某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合溶液的pH如下表:
| 实验编号 |
HA的浓度(mol·L-1) |
NaOH的浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其他组的实验情况,单从甲组分析如何用a来分析HA属于强酸还是弱酸:_____。
(2)不考虑其他组的实验情况,单从乙组分析c是否一定等于0.2?________。混合溶液中离子浓度c(A-)与c(Na+)的大小关系为________。
(3)从丙组结果分析HA是________酸,该混合溶液中离子浓度大小关系为________。
(4)丁组实验混合溶液中由水电离的c(OH-)=_____________mol·L-1。
常温下有浓度均为0.5 mol·L-1的四种溶液:①碳酸钠溶液②碳酸氢钠溶液③盐酸④氨水。请根据题目要求回答下列问题:
(1)上述溶液中,可发生水解反应的是___________(填序号,下同),在发生水解反应的溶液中pH最大的是____________________。
(2)上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是____________________。
(3)取适量溶液④,加入少量氯化铵固体,此时溶液中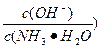 的值_________(填“增大”“减小”或“不变”)。
的值_________(填“增大”“减小”或“不变”)。
(4)将等体积的③和④的溶液混合后,所得溶液中离子浓度由大到小的顺序是___________。
(5)取10 mL溶液③,加水稀释到500 mL,则该溶液中由水电离出的c(H+)=______________。
试题篮
()