FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3氧化FeCl2的离子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++ =
= Cl-+
Cl-+ Fe3++
Fe3++ .
.
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+——K1
Fe(OH)2++H+——K1
Fe(OH)2++H2O Fe(OH)2++H+——K2
Fe(OH)2++H+——K2
Fe(OH)2++H2O Fe(OH)3+H+——K3
Fe(OH)3+H+——K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
(4)FeCl3也可以用作SO2尾气的吸收剂,原理上与NaOH吸收SO2有何不同______________________
(5)电解时,微粒的放电顺序遵循微粒得失电子能力的强弱,SO32—具有强的还原性。用NaOH吸收烟气中的SO2,将所得的Na2SO3溶液用碳棒进行电解,写出阳极电极反应_____________________________
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
(1)一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是 (填序号)
A.每消耗1mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如下图所示。
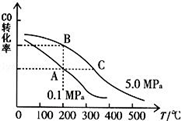
B、C两点的平衡常数K(B) K(C)(填“>”、“=”或“<”).
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率= ,此温度下的平衡常数K= (保留二位有效数字)
(2)常温下,将V mL、0.20mol/L氢氧化钠溶液逐滴加入到20.00mL、0.20mol/L甲酸溶液中,充分反应,溶液pH=7,此时V 20.00(填“>”、“=”或“<”);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液中所含离子浓度由大到小顺序__ _____
(3)温度650℃的熔融盐燃料电池,用(CO、H2)作反应物,空气与CO2的混合气体为正极反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质.该电池的正极反应式为
(4)己知:CH3OH、H2的燃烧热(△H)分别为﹣726.5kJ/mol、﹣285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是
(1)常温下某溶液中由水电离出的离子浓度符合c(H+)·c(OH-)=1×10-20的溶液,其pH为____________,此时水的电离受到______________。
(2)已知:2NO2(g)===N2O4(g)ΔH=-57.20 kJ·mol-1。一定温度下,在密闭容器中反应2NO2(g)===N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)。
A.减小NO2的浓度 B.降低温度
C.增加NO2的浓度 D.升高温度
(3)在某温度下,H2O的离子积常数为1×10-13 mol2·L-2,则该温度下:
①0.01 mol·L-1NaOH溶液的pH=_____________;
②100 mL 0.1 mol·L-1H2SO4溶液与100 mL 0.4 mol·L-1的KOH溶液混合后,pH=___________。
(4)已知一溶液有4种离子:X+、Y-、H+、OH-,下列分析结果肯定错误的是______________。
A.c(Y-)>c(X+)>c(H+)>c(OH-) B.c(X+)>c(Y-)>c(OH-)>c(H+)
C.c(H+)>c(Y-)>c(X+)>c(OH-) D.c(OH-)>c(X+)>c(H+)>c(Y-)
(5)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显___________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________________。
(6)水溶液中的行为是中学化学的重要内容。已知下列物质的电离常数值(25 ℃):
HClO:Ka=3×10-8 HCN:Ka=4.9×10-10 H2CO3:Ka1=4.3×10-7 Ka2=5.6×10-11
84消毒液中通入少量的CO2,该反应的化学方程式为_____________________。
常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1 L溶液
(1)该溶液中除H2O的电离平衡外还存在的平衡体系是__________。
(2)溶液中共有________种不同的微粒。
(3)这些粒子中浓度为0.01mol·L-1的是________,浓度为0.002mol·L-1的是_________。
(4)物质的量之和为0.01mol的两种微粒是__________。
某些非金属单质可以与强碱溶液发生反应。例如白磷(P4)可以与过量的热NaOH溶液反应生成PH3气体和NaH2PO2(次磷酸钠)。
(1)上述反应的化学方程式为 。
(2)已知NaH2PO2水溶液pH>7,次磷酸是 元(填“一”、“二”或“三”) (填“强”或“弱”)。次磷酸的电离方程式为: ;NaH2PO2水溶液pH>7的原因: 。
(3)25℃时,向100mL0.01mol∙L-1的H3PO2溶液中,滴加等浓度的NaOH溶液至溶液呈中性,消耗NaOH溶液的体积 (填“>”、“=”或“<”)100ml。此时溶液中离子浓度由大到小的顺序是 。
硫和氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要举措。
(1)研究发现利用NH3可消除硝酸尾气中的NO污染。NH3与NO的物质的量之比分别为1﹕3、3﹕1、4﹕1时,NO脱除率随温度变化的曲线如图所示:
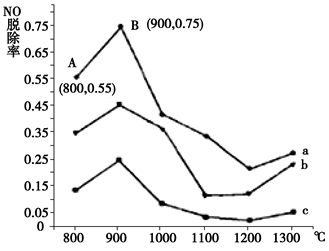
①用化学反应方程式表示NH3消除NO的反应原理 (不用注明反应条件)。
②曲线b 对应NH3与NO的物质的量之比是 。
③曲线a中,NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8 s,该时间段内NO的脱除速率为____ mg/(m3·s)。
(2)NO、NO2混合气体能被NaOH溶液吸收生成NaNO2和NaNO3,若吸收的溶液中N的浓度为ag·L- 1,要使1m3该溶液中的完全转化为,至少需通入标准状况下的O2 L。(用含a的代数式表示,计算结果保留整数)
(3)SO2被少许NaOH溶液吸收生成能使pH试纸变红的NaHSO3溶液,工业上可电解NaHSO3得到重要化工产品Na2S2O4。
①NaHSO3溶液中离子浓度大小为 。
②写出生成S2的电极反应式 。
工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下:
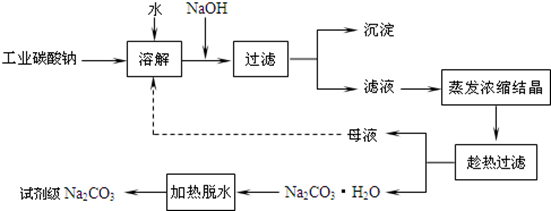
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
(1)加入NaOH溶液时发生的离子反应方程式为 、 。
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释) 。
(3)“趁热过滤”时的温度应控制在 。
(4)已知:Na2CO3·10 H2O(s)=Na2CO3(s)+10 H2O(g) △H=+532.36kJ·mol—1
Na2CO3·10 H2O(s)=Na2CO3·H2O(s)+9 H2O(g) △H=+473.63kJ·mol—1
写出Na2CO3·H2O脱水反应的热化学方程式 。
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用。请你分析实际生产中是否可行 ,其理由是 。
氮和硫的化合物对大气都有严重污染,据所学化学反应原理回答下列问题:
(1)NO2与悬浮在大气中海盐粒子的相互作用时发生反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) ∆H =" a" KJ/mol
NaNO3(s)+ClNO(g) ∆H =" a" KJ/mol
则该反应为 反应(填放热或吸热),产物ClNO的结构式为 。
(2)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为 (已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数K a=1.7×10-5mol/L,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(3)若将SO2,NO2,O2按4:4:3通入水中充分反应,写出总的离子方程式 。
(4)向氨水中通入过量的H2S,所得溶液M中溶质的电子式为 ;取0.2mol/L的NaOH溶液与0.1mol/L的M溶液等体积混合,加热至充分反应后,待恢复至室温,剩余溶液中离子浓度由大到小的顺序是 ,此时测得溶液的pH=12,则此条件下M溶液中阴离子的电离平衡常数Ka= (提示:若涉及多元弱酸的电离或多元弱酸根离子的水解,均只考虑第一步电离或水解)
(共14分)SO2的含量是空气质量日报中一项重要检测指标,请结合所学知识回答下列问题。
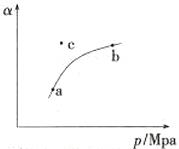
(1)工业制硫酸过程中,SO2催化氧化的原理为:2SO2(g)+O2(g) 2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO3(g) 。T℃时,向某密闭容器中充入一定SO2(g)和O2(g),发生上述反应,测得SO2(g)的平衡转化率(a)与体系总压强(p)的关系如图所示。
①a、b两点对应的平衡常数K(a) K(b)(填“>”、“<”或“=”,下同),SO2浓度c(a) c(b)。
②c点时,反应速率v(正) v(逆)。
(2)电化学法处理SO2。
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如下图所示(电极均为惰性材料):
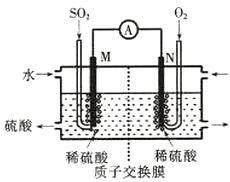
①M极发生的电极反应式为 。
②若使该装置的电流强度达到2.0A,理论上每分钟应向负极通入标准状况下气体的体积为 L(已知:1个e-所带电量为1.6×10-19C)。
(3)溶液法处理SO2。已知常温下H2SO3和H2CO3的电离常数如下表所示:

常温下,将SO2缓慢通入100mL 0.2mol•L-1的Na2CO3溶液中,当通入448mLSO2时(已折算为标准状况下的体积,下同),发生的离子方程式为 ;当通入896mLSO2时,所得溶液呈弱酸性,溶液中各离子浓度由大到小的顺序为 。
实验室制备少量硫酸亚铁晶体的实验步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口、静置、冷却一段时间后有浅绿色晶体析出,收集产品。
(1)写出该实验制备硫酸亚铁的化学方程式:________________;
(2)采用水浴加热的原因是___________________;
(3)反应时铁屑过量的目的是(用离子方程式表示)_________________;
(4)溶液趁热过滤的原因是__________________;
(5)塞紧试管口的目的是 。
(1)与明矾相似,硫酸铁也可用作净水剂,其原理为_________(用离子方程式表示)。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为___________________。
(3)已知:S2O32—有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为S2O82—+2I-=2SO42—+I2①、I2+2S2O32-=2I-+S4O62—②。S2O82—、S4O62—、I2氧化性强弱顺序:__________。
(4)已知溶液中,还原性为HSO3—>I-,氧化性为IO3—>I2>SO42—。在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。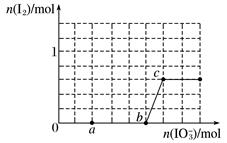
a点处的还原产物是__________(填离子符号);
b点→c点反应的离子方程式是__________________。
(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系。下表为几种弱酸在25℃时的电离平衡常数
回答下列问题:
(1)K只与温度有关,当温度升高时,K值____(填“增大”、“减小”、“不变”)。
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是_________,最弱的是________。
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是________;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因______ _。
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的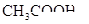 的电离转化率为____,则该温度下醋酸的电离平衡常数
的电离转化率为____,则该温度下醋酸的电离平衡常数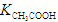 _____。
_____。
(二)化合物SOCl2是一种液态化合物,沸点77 ℃。在盛有10 mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色。
(1)写出SOCl2和水反应的化学方程式:_____________________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是 ;用SOCl2与AlCl3·6H2O混合共热得到无水AlCl3,原因是________________________ 。
试题篮
()