(1)一定温度下,有a.盐酸;b.硫酸;c.醋酸三种酸,用字母填写下列空格:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________________________。
②若三者c(H+)相同时,物质的量浓度由大到小的顺序是_________________________。
(2)常温下,0.1 mol·L-1的HCl溶液中,由水电离出来的H+浓度为________mol·L-1。
(3)在一元强碱MOH溶液中加入一元酸HA溶液,充分反应后,溶液呈中性。甲同学认为溶液中c(A-)=c(M+),而乙同学认为c(A-)和c(M+)是否相等,要看一元酸HA是强酸还是弱酸。你认为__________同学的说法正确,理由是____________________________。
(4)明矾[KAl(SO4)2·12H2O]常用作净水剂,其原理是_______________(用离子方程式表示)。
(5)将FeCl3溶液蒸干并灼烧,最终得到的固体物质是______________________(填写化学式)。
硫及其化合物有广泛应用。
(l)硫酸生产过程中涉及以下反应。已知25℃、10lkPa时:

则SO2催化氧化为SO3(g)的热化学方程式为
(2)对于SO2催化氧化为SO3的反应。
①图甲是SO2(g)和SO3(g)的浓度随时间t的变化情况。反应从开始到达到平衡时,用O2表示的平均反应速率为

②在一容积可变的密闭容器中充入20mol SO2(g)和10mol O2(g),O2的平衡转化率随温度(T)、压强(p)的变化如图乙所示。则p1与p2的大小关系是p1 p2:(填“>”“<”或“=”);A、B、C三点的平衡常数大小关系为 ( ),理由是
),理由是
(3)工业生产硫酸过程中,通常用氨水吸收尾气
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为
所得溶液中 = (填序号)。
= (填序号)。

②已知在25℃时NH3·H2O、H2SO3电离平衡常数如下表,则上述所得溶液中,各离子浓度由大到小的顺序为

常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)上述溶液中,可发生水解的是_______ _(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为_________________________。
(3) 向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值________(填“增大”、“减小”或“不变”)。
(4) 若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是________________。
(5) 取10 mL溶液③,然后加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________ 。
平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵晶体:

ⅰ.酸性条件下,铈在水溶液中有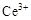 、
、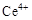 两种主要存在形式,
两种主要存在形式,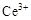 易水解,
易水解,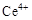 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵晶体广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂C的是 。
| A.NaClO | B.H2O2 | C.KMnO4 | D.浓硫酸 |
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(3)反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号);反应①的离子方程式为 。
(4)用滴定法测定制得的Ce(OH)4产品纯度:

滴定时所用定量仪器的最小刻度为 ;所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
KHCO3 ,溶液呈 性;
K2SO4 ,溶液呈 性;
CuCl2 ,溶液呈 性。
电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
| 化学式 |
电离平衡常数 |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_________。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得C(Na+)>C(CN-),下列关系正确的是 。
A.C(H+)>C(OH-) B.C(H+)<C(OH-)
C.C(H+)+C(HCN) = C(OH-) D.C(HCN)+ C(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理________________________________ 。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;质子守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO +H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
+H+→CO2+Mn2++H2O,若将该反应设计成原电池,请写出原电池的负极的电极反应___________________,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
“优先反应思想”是一条重要的化学学科思想。根据所学知识及题目提供的相关数据,回答下列问题:
(1)向FeBr2溶液中滴加少量氯水,溶液变黄。你认为使溶液变黄的微粒其符号是_________,用实验证明你的观点,简述实验操作及现象___________________________。
(2)己知常温下一些电解质的相关数据见下表:
| H2CO3 |
Ka1=4.3×10-7 |
HClO |
Ka=2.95×10-8 |
| Ka2=5.61×10-11 |
AgCl |
Ksp=1.77×10-10 |
|
| CH3COOH |
Ka=1.76×10-5 |
Ag2CrO4 |
Ksp=1.12×10-12 |
①向等物质的量浓度的Na2C03, CH3COONa, NaClO组成的混合溶液中逐滴加入稀硫酸,首先发生反应的离子方程式是___________________________________________。
②向浓度均为0.010 mol/L的NaCl, Na2Cr04组成的混合溶液中逐滴加入浓度为0.010 mol·L-1AgN03溶液,首先生成的沉淀其化学式为___ _ 。
(3)分别向四份各100 mL,浓度均为2 mo1L-1的FeC13溶液中,加入铁、铜组成的均匀粉末状混合物,得到如下数据:
| |
I |
Ⅱ |
Ⅲ |
Ⅳ |
| FeCl3溶液体积/mL |
100 |
100 |
100 |
100 |
| 加入粉末质量/g |
3 |
6.6 |
9 |
12 |
| 剩余粉末质量/g |
0 |
0.64 |
3.2 |
6.4 |
①根据表中的数据可求出粉末中铁、铜的物质的量之比为______________。
②根据表中的数据分析I反应后的溶液中存在的金属阳离子有〔用离子符号表示)______________。
Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
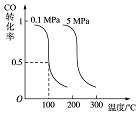
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率 (填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。

(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。若由体积相等的氢氧化钠溶液和醋酸溶液混合且恰好呈中性,则混合前c(NaOH) c(CH3COOH)
(3)在D点,溶液中离子浓度大小关系为_____________________。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的 pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸___________________________。
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2________(选填“是”或“否”),混合液中离子浓度c(A-)与 c(Na+)的大小关系是________________________。
(3)丙组实验结果分析,HA是________酸(选填“强”或“弱”),该混合溶液中离子浓度由大到小的顺序是____________________。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。
写出该混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=________mol·L-1 , c(OH-)-c(HA)=________mol·L-1
某二元酸(化学式用H2B表示)在水中的电离方程式H2B=H++HB-;HB- H++B2-回答下列问题:
H++B2-回答下列问题:
(1)Na2B溶液显______(填“酸性”,“中性”,或“碱性”)。理由是___________(用离子方程式表示)。
(2)在0.1 mol/L 的Na2B溶液中,下列粒子浓度关系式正确的是
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol/L NaHB溶液的pH=2,则0.1 mol/L H2B溶液中氢离子的物质的量浓度可能是____0.11 mol/L(填“<”、“>”、“=”)理由是: 。
(4)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是_____________。
(1)常温下,0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则
①混合溶液中由水电离出的c(H+) (填“>”、“<” 或“=”)原HCl溶液中由水电离出的c(H+)。
②求出混合溶液中下列算式的精确计算结果(填具体数字)。c(Cl-)-c(M+)= mol·L-1;
(2)常温下,若将0.2 mol·L-1MOH溶液与0.1 mol·L-1HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下,MOH的电离程度 (填“大于”、“小于”或“等于”) MCl的水解程度。
(3)常温下,若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH (填“>7”或“< 7”或“无法确定”)。
(4)AgNO3的水溶液呈 (填“酸”、“中”或“碱”)性,原因是(用离子方程式表示) ;实验室在配制AgNO3溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后用蒸馏水稀释到所需的浓度,以 (填“促进”或“抑制”)其水解。
(5)把FeCl3溶液蒸干、灼烧,最后得到的固体产物主要是 。
(1)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8。
①混合液中由水电离出的OH-浓度与0.1mol·L-1NaOH溶液中由水电离出的OH-浓度之比为 ;
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为(填序号) 。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。图甲所示装置中,以稀土金属材料为惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的

①c电极为_____,d电极上的电极反应式为______________________。
②图乙是用惰性电极电解100mL 0.5mol·L-1 CuSO4溶液,a电极上的电极反应式为________________。若a电极产生56mL(标准状况)气体,则所得溶液的pH=_______________(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入____________(选填字母序号)
| A.CuO | B.Cu(OH)2 | C.CuCO3 | D.Cu2(OH)2CO3 |
回答下列问题:
(1)某溶液可能呈酸性或碱性,此外还有Na+、SO42-和Cl-,且测得此三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是 。
(3)液氨类似于水的电离,试写出液氨的电离方程式 。
(4)某二元酸(H2A)在水中的电离方程式是:H2A=H++HA- , HA- H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因:
H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因:
电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
| 化学式 |
电离平衡常数 |
| HCN |
K=4.9×10-10 |
| CH3COOH |
K=1.8×10-5 |
| H2CO3 |
K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为________________________________。(填写序号)
(2)25 ℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为______ ___。
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是 。
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-)
D.c(HCN)+ c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_____________________。
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小___________________;电荷守恒表达式 ___________________ 。
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,外电路中通过的电子的物质的量为__________mol。
A、B代表不同的物质,都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈碱性、B的水溶液呈酸性,请找出A、B可能的两种组合。要求:相同浓度时,A1溶液中水电离程度小于A2溶液中水电离程度,B1溶液中水电离程度小于B2溶液中的水电程度。
(1)写出化学式:Al :____;A2:___;Bl :___;B2:____
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的氢离子的物质的量浓度之比为________
(3)写出0.l mol·L-1的A2溶液中离子浓度的大小排列______。
(4)B1溶液中水的电离程度小于B2溶液中水的电离程度,原因是___________。
(5)若常温下B1、B2两溶液的pH = 5,则两溶液中水电离出的氢离子的物质的量浓度之比为_______。
试题篮
()